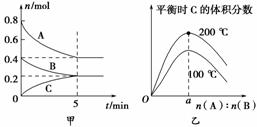- 化学平衡常数的含义
- 共77题
据报道,在一定条件下,由CO2和H2合成乙醇已成为现实,该合成对解决能源问题具有重大意义。
(1)CO2和H2合成乙醇的化学方程式为:
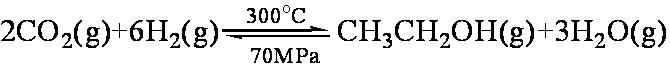
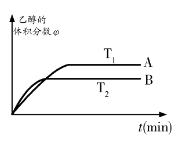
如果只是压强增大,则该反应的化学平衡常数K将 (填:“增大”、“减小”或“不变”);
②从上图可知,该平衡正向的ΔH 0(填“>”、“<”或“=”)。
(2)对于该化学平衡,为了提高H2的转化率,可采取的措施有 。
A.加压
B.升温
C.加催化剂
D.增加CO2的浓度
(3)已知25oC、101 kPa条件下,1 g乙醇燃烧生成CO2和液态水时释放出a kJ热量,请写出该条件下乙醇燃烧热的热化学反应方程式: 。
(4)现有甲装置为原电池(a电极通氧气,b电极通乙醇),乙装置为电解池:
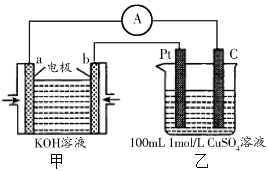
② 若甲中有0.01mol CH3CH2OH参加反应,则乙装置中生成的气体在标准状况下的体积共为 L 。
正确答案
见解析。
解析
(1)① 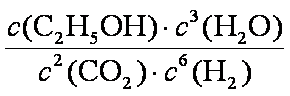
(2)A、D ;
(3)C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH=-46a kJ/mol ;
(4)①C2H5OH-12e-+16OH-=2CO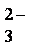
②0.672 。
知识点
降低太气中

(1)将燃煤废气中的

①某温度下,将2。0mol
则











②一定条件下,上述反应在密闭容器中达平衡。当仅改变影响反应的一个条件,引起的下列变化能说明平衡一定向正反应方向移动的是________。
a. 反应物的浓度降低
b. 容器内压强增大
c. 正反应速率大于逆反应速率
d. 化学平衡常数K增大
(2)碳酸氢钾溶液加水稀释,

a.
b.
c. 降低温度,
正确答案
(1) ①>;<;57.14%;② cd
(2)增大;b
(3)2Fe3+ +3CO32-+3H2O=2Fe(OH)3(胶体)+3CO2↑
解析
略。
知识点
在2 L的密闭容器中发生反应xA(g)+yB(g)
正确答案
解析
略
知识点
一定条件下,分别向容积固定的密闭容器中充入A和足量B,发生反应如下:
2A (g) +B (s) 
正确答案
解析
略
知识点
一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g) 
正确答案
解析
略。
知识点
大气中的部分碘源于O3对海水中I-的氧化。将O3持续通入NaI溶液中进行模拟研究。
(1)O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+ O3(g)= IO-(aq)+O2(g)△H1
②IO-(aq)+H+(aq) 
③HOI(aq) + I-(aq) + H+(aq) 
总反应的化学方程式为________,其反应△H=________。
(2)在溶液中存在化学平衡:I2(aq) + I-(aq) 
(3) 为探究Fe2+ 对O3氧化I-反应的影响(反应体如图13),某研究小组测定两组实验中I3-浓度和体系pH,结果见图14和下表。
①第1组实验中,导致反应后pH升高的原因是________。
②图13中的A为__ ___,由Fe3+生成A的过程能显著提高Ⅰ-的转化率,原因是________。
③第2组实验进行18s后,I3-浓度下降。导致下降的直接原因有(双选)________。
A. c(H+)减小
B. c(I-)减小
C. I2(g)不断生成
D. c(Fe3+)增加
(4)据图14,计算3-18s内第2组实验中生成I3-的平均反应速率(写出计算过程,结果保留两位有效数字)。
正确答案
(1) O3+2Ⅰ—+2H+=Ⅰ2+ O2+ H2O,△H=△H1+△H2+△H3。
(2)
(3)反应过程中消耗氢离子,溶液酸性减弱,pH增大,水电离出氢离子参与反应破坏水的电离平衡,氢氧根浓度增大,溶液呈碱性,pH增大;Fe3+,该过程是非氧化还原;BD
(4)(计算过程略)5.5×10—4 mol/L·s
解析
略。
知识点
运用化学反应原理研究氮、氯等单质及其化合物的反应有重要意义。
(1)科学家研究在一定条件下通过下列反应制备NH3:
①在其他条件相同时,反应中NH3的体积分数(a)在不同温度下随反应时间(t)的变化如图。该反应的平衡常数表达式K=________,该反应中的ΔH________0(填“>”“<”或“=”)。
②某温度下,在2L容积不变的密闭容器中加入1molN2和6molH2O(l)发生反应,转化率随时间(f)变化如图。15-20min内,v(NH3)=________。若其他
(2) 25℃时,某同学将O.lmol


(3) 25℃时,向O.lmol




正确答案
(1)①
(2)>;>
(3)白色沉淀逐渐变成红褐色;Mg2++2NH3·H2O=Mg(OH)2↓+2NH4+;2Fe3+(aq)+3Mg(OH)2(s)=2Fe(OH)3(s)+3Mg2+(aq)
解析
略。
知识点
面对能源与环境等问题,全球大力发展新能源的同时,还倡导节能减排、低碳经济。请回答下列问题:
Ⅰ、氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
已知:
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。


(2)电解尿素CO(NH2)2的碱性溶液制氢的装置如图所示(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极的电极反应式为 。




应,生成MgCu2和仅含一种金属元素的氢化物(其中
氢的质量分数为0.077)。则

方程式为 。
Ⅱ、碘钨灯具有使用寿命长、节能环保等优点。一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生可逆反应:


(4)该反应是 (填写“放热”或“吸
热”)反应。在450℃时,该反应的平
衡常数K= 。
(5)若保持450℃温度不变,向该容器中再加入0.508 g碘,当再次达到平衡时,反应混合气体中I2的百分含量 (填“变大”、“不变”或“变小”)。
(6)若保持450℃温度不变,向该容器中再加入0.002 mol W、0.000 6 mol I2、0.0054 mol WI2,则化学平衡 (填“正向移动”、“不移动”或“逆向移动”)。
正确答案
(1)
(2)
(3)
(4)放热;9
(5)不变
(6)不移动
解析
略
知识点
火力发电厂释放出大量气体会造成环境污染。对燃煤废气进行处理,可实现绿色环保、废物利用等目的。
(1)CO可以与H2O(g)发生反应:CO(g) + H2O(g) 
在甲、乙、丙三个恒容密闭容器中,起始时按照下表进行投料,在800℃时达到平衡状态,K=1.0。
①该反应的平衡常数表达式为 。
②平衡时,丙容器中H2O的物质的量是 mol,甲容器中CO的转化率是 ,
容器中CO的转化率:乙 甲(填“>”、“=”或“<”)。
③丙容器中,其他条件不变时,温度 (填“升高”或“降低”),CO的平衡转化率升高。
(2)除去氮氧化物:
① 利用甲烷催化还原NOx:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160 kJ·mol-1
甲烷直接将NO2还原为N2的热化学方程式为__________
② 也可用氨气与之发生反应:NOx+NH3→N2+H2O。
现有NO2和NO的混合气体3.0 L,跟3.4 L(同温同压下)NH3反应,恰好使其全部转化为氮气,则原混合气体中,NO2与NO的体积比是__________。
正确答案
见解析。
解析
(1)①
②0.1 50% >
③ 降低
(2)①CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol (3分)
② 7 : 3
知识点
硫的化合物在生产和科研中发挥着重要作用。
(1)SO2Cl2常用于制造医药品、染料、表面活性剂等。已知:
SO2Cl2(g)
某温度时向体积为1 L的恒容密闭容器中充入0. 20mol SO2Cl2,达到平衡时,容器中含0.18mol SO2,则此过程反应吸收的热量为________kJ,该温度时反应的平衡常数为________。将上述所得混合气体溶于足量BaCl2溶液中,最终生成沉淀的质量为________。
(2)工业上制备硫酸的过程中存在反应:
2SO2(g)+O2(g) 
400℃,1.01×105Pa,向容积为2L的恒容密闭容器中充入一定量 SO2和O2,n(SO3)和n(O2)随时间的变化曲线如图所示。
①0~20min反应的平均速率υ(O2)=________。
②下列叙述正确的是________。
a. A点υ正(SO2) >υ逆(SO2)
b. B点处于平衡状态
c. C点和D点n(SO2)相同
d. 其它条件不变,500℃时反应达平衡,n(SO3)比图中D点的值大
(3)工业上用Na2SO3溶液吸收烟气中的SO2。将烟气通入1.0 mol·L-1的Na2SO3溶液,当溶液pH约为6时,Na2SO3溶液吸收SO2的能力显著下降,应更换吸收剂。此时溶液中c (SO32-)的浓度是0.2 mol·L-1,则溶液中c(HSO3-)是________mol·L-1。
正确答案
(1)17.5;1.62;46.6g
(2)0.02mol/(L·min);ac;1.6mol·L-1
解析
略。
知识点
扫码查看完整答案与解析