- 用化学平衡常数进行计算
- 共25题
用氮化硅(Si3N4)陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅,其反应如下:
3SiCl4(g)+2N2(g)+6H2(g)
完成下列填空:
(1)在一定温度下进行上述反应,若反应容器的容积为2 L,3 min后达到平衡,测得固体的质量增加了2.80 g,则H2的平均反应速率___ mol/(L·min);该反应的平衡常数表达式K=_____
(2)上述反应达到平衡后,下列说法正确的是_。
a.其他条件不变,压强增大,平衡常数K减小
b.其他条件不变,温度升高,平衡常数K减小
c.其他条件不变,增大Si3N4物质的量平衡向左移动
d.其他条件不变,增大HCl物质的量平衡向左移动
(3)一定条件下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是__。
a.3v逆(N2)=v正(H2)
b.v正(HCl)=4v正(SiCl4)
c.混合气体密度保持不变
d.c(N2):c(H2):c(HCl)=1:3:6
(4)若平衡时H2和HCl的物质的量之比为

正确答案
(1) 0.02 、 
(2)bd
(3)ac ;
(4)<
解析
本题考查化学反应速率与化学平衡,意在考查考生的思维能力和分析、推断能力。
(1)由方程式可知固体(Si3N4)质量增加2.80g时消耗n(H2)=2.80g/140g·mol-1×6=0.12mol,故v(H2)=0.12mol/(2L·3min)=0.02mol/(L·min);利用反应方程式可直接写出反应的平衡常数表达式。
(2)因反应为放热反应,故反应达到平衡后,升高温度,平衡逆向移动,平衡常数K减小,b正确、温度不变,加压或改变反应物的浓度等平衡常数不变,a错误、其他条件不变,增加固体Si3N4平衡不移动,c错误、其他条件不变,增大HCl的物质的量,平衡向消耗HCl的逆反应方向移动,d正确。
(3)利用化学反应速率之比等于化学方程式计量系数比可知a项叙述表示v正=v逆,表示反应达到平衡态;b项均表示正反应,无论反应是否处于平衡态,都成立;d项表示的浓度关系与是否平衡无关;混合气体密度不变说明溶液中气体质量不变,而平衡移动则气体质量改变,所以c项表示达到平衡态。
(4)降低温度,平衡正向移动,n(H2)/n(HCl)变小。
知识点
硼酸(H3BO3)在食品、医药领域应用广泛。
(1)请完成B2H6气体与水反应的化学方程式:B2H6 + 6H2O=2H3BO3 +________。
(2)在其他条件相同时,反应H3BO3 +3CH3OHB(OCH3)3 +3H2O中,H3BO 3的转化率(
① 温度对应该反应的反应速率和平衡移动的影响是_______.
② 该反应的
(3)H3BO 3溶液中存在如下反应:
H3BO 3(aq)+H2O(l)=[B(OH)4]-( aq)+H+(aq).已知0.70 mol·L-1 H3BO 3溶液中,上述反应于298K达到平衡时,c平衡(H+)=2. 0 × 10-5mol·L-1,c平衡(H3BO 3)
正确答案
(1)B2H6 + 6H2O=2H3BO3 +6H2
(2) ①升高温度,反应速率加快,平衡正向移动
② >
(3)解依题意 H3BO 3(aq)+H2O(l)= [B(OH)4]-( aq)+H+(aq)
解析
略
知识点
氯气在298K、100kPa时,在1L水中可溶解0.09mol,实验测得溶于水的Cl2约有三分之一与水反应。请回答下列问题:
(1)该反应的离子方程式为__________;
(2)估算该反应的平衡常数__________(列式计算)
(3)在上述平衡体系中加入少量NaOH固体,平衡将向__________移动;
(4)如果增大氯气的压强,氯气在水中的溶解度将__________(填“增大”、“减小”或“不变”),平衡将向__________移动。
正确答案
(1)
(2)
C起 0.09 0 0 0
C变 0.09×
C平 0.06 0.03 0.03 0.03

(3)正反应方向;
(4)增大,正反应方向
解析
略。
知识点
碳单质在工业上有多种用途。
(1)焦炭可用于制取水煤气。测得12 g 碳与水蒸气完全反应生成水煤气时,吸收了131.6 kJ热量。该反应的热化学方程式是 。
(2)活性炭可处理大气污染物NO。在2 L密闭容器中加入NO和活性炭(无杂质),生成气体E和F。当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
①请结合上表数据,写出NO与活性炭反应的化学方程式 。
②上述反应T1℃时的平衡常数为K1,T2℃时的平衡常数为K2。
Ⅰ,计算K1= 。
Ⅱ,根据上述信息判断,温度T1和T2的关系是(填序号)__________。
a.T1>T2
b.T1<T2
c.无法比较
③在T1温度下反应达到平衡后,下列措施不能改变NO的转化率的是 。
a.增大c(NO)
b.增大压强
c.升高温度
d.移去部分F
(3)工业上可用焦炭冶炼金属。若0.5 mol碳完全与赤铁矿反应,得到0.6 mol铁,同时生成2种常见气体,则该反应的化学方程式是 。
正确答案
见解析。
解析
(1)C(s)+H2O(g)=CO(g)+H2(g) ΔH=+131.6 kJ•mol—1
(2)①
②Ⅰ:9/16
Ⅱ:c
③a b
(3)
知识点
甲醇是重要的化学工业基础原料和清洁液体燃料,它广泛用于有机合成、医药、农药、涂料、染料、汽车和国防等工业中。工业上一般在恒容密闭容器中采用下列反应合成甲醇:
CO(g)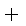
下表所列数据是反应在不同温度下的化学平衡常数(K)。
(1)判断反应达到平衡状态的依据是
A,混合气体的密度不变
B,混合气体的平均相对分子质量不变
C,生成CH3OH的速率与消耗CO的速率相等
D。CH3OH、CO、H2的浓度都不再发生变化
(2)由表中数据判断Q 0 (填“>”、“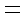
A,加入催化剂 B,充入CO C,充入H2 D,升温
(3)某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应10min后,达到平衡时测得c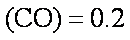
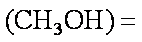
(3)原料CO和H2可以由C和H2O反应制取,涉及的反应方程式如下:
C(s)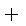

C(s)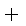

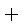
CO(g)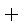

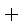
则K1、K2 、K3之间的关系是: 。
正确答案
(1) BD
(2)>、C
(3)0.08 80%
(4) K2=K1·K3
解析
略
知识点
某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM25(直径小于等于2.5
请回答下列问题:
(1)将PM25样本用蒸馏水处理制成待测试样。
若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
根据表中数据判断PM25的酸碱性为 ,试样的pH= 。
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+


写出焦炭与水蒸气反应的热化学方程式: 。
②洗涤含SO2的烟气。以下物质可作洗涤剂的是 。
a。Ca(CH)2 b。Na2CO3 c。CaCl2 d。NaHSO3
(3)汽车尾气中NOx和CO的生成及转化
①已知汽缸中生成NO的反应为:


若1mol空气含0.8molN2和0.2molO2,1300oC时在密闭容器内反应达到平衡,测得NO为8×10-4mol。计算该温度下的平衡常数K= 。
汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是 。
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:
2CO(g)=2C(s)+O2(g)
已知该反应的△H
③目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为
。
正确答案
见解析
解析
解析:。
知识点
在1.0 L密闭容器中放入0.10molA(g),在一定温度进行如下反应:
反应时间(t)与容器内气体总压强(p)的数据见下表:
回答下列问题:
(1)欲提高A的平衡转化率,应采取的措施为 。
(2)由总压强P和起始压强P0计算反应物A的转化率α(A)的表达式为 。
平衡时A的转化率为_ ,列式并计算反应的平衡常数K 。
(3)①由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),n总= mol,n(A)= mol。
②下表为反应物A浓度与反应时间的数据,计算a=
正确答案
答案:
(1)升高温度、降低压强
(2)
(3)
②0.051;每间隔4小时,A的浓度为原来的一半。0.013
解析
(1)根据反应是放热反应特征和是气体分子数增大的特征,要使A的转化率增大,平衡要正向移动,可以采用升高温度、降低压强的方法。
(2)反应前气体总物质的量为0.10mol,令A的转化率为α(A),改变量为0.10α(A) mol,根据差量法,气体增加0.10α(A)mol,由阿伏加德罗定律列出关系:
平衡浓度C(C)=C(B)=0.1×94.1%=0.0941mol/L,C(A)=0.1-0.0941=0.0059mol/L,
(3)

每间隔4小时,A的浓度为原来的一半。
当反应12小时时,C(A)=0.026/2=0.013mol/L
知识点
工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
某小组研究在相同温度下该反应过程中的能量变化。他们分别在体积均为V L的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应。相关数据如下:

“小于”或“等于”)生成物分子化学键形成时所释放的总能量。
(2)容器①中反应达平衡时,CO的转化率为 %。
(3)计算容器②中反应的平衡常数K= 。
(4)下列叙述正确的是 (填字母序号)。
a.平衡时,两容器中H2的体积分数相等
b.容器②中反应达平衡状态时,Q > 65.6 kJ
c.反应开始时,两容器中反应的化学反应速率相等
d.容器①中,反应的化学反应速率为:
(5)已知:2H2 (g) + O2 (g) == 2H2O (g) ΔH=-484 kJ/mol,写出CO完全燃烧生成CO2
的热化学方程式: 。
(6)容器①中反应进行到t min时,测得混合气体中CO2的物质的量为0.6 mol。若用
200 mL 5 mol/L的NaOH溶液将其完全吸收,反应的离子方程式为(用一个离子方
程式表示) 。
正确答案
见解析。
解析
(1)小于
(2)80
(3)1
(4)a
(5)2CO(g) + O2(g) === 2CO2(g) △H = -566 kJ/mol
(6)3CO2 + 5OH- === 2CO32- + HCO3- + 2H2O
知识点
(1)电镀是,镀件与电源的 极连接。
(2)化学镀的原理是利用化学反应生成金属单质沉淀在镀件表面形成的镀层。
①若用铜盐进行化学镀铜,应选用 (填“氧化剂”或“还原剂”)与之反应。
②某化学镀铜的反应速率随镀液pH变化如右图所示。该镀铜过程中,镀液pH控制在12.5左右。据图中信息,给出使反应停止的方法:
(3)酸浸法制取硫酸铜的流程示意图如下:
①步骤(i)中
②步骤(ii)所加试剂起调节pH作用的离子是 (填离子符号)。
③在步骤(iii)发生的反应中,1mol
④步骤(iv)除去杂质的化学方程式可表示为
过滤都母液的pH=2.0,c(





正确答案
见解析。
解析
(1)负;考察电镀池的常规考题。送分题。
(2)①还原剂;要使铜离子得电子转化为铜单质,只能用还原剂。本题考察氧化还原反应的最普通知识,又是送分题。
②调节溶液PH在8-9之间。从图表信息可知,当PH在8-9之间时候,反应速率为0,有些同学可能会问在PH为什么一定要大于8,别忘了化学镀铜用的还原剂一般是比铜活泼的还原剂(比如活泼金属),那么在酸性条件下,可能会产生H2,因此最好在碱性条件下调节PH。
(3)①Cu2(OH)2CO3+2H2SO4=== 2CuSO4+3H2O+ CO2↑ 能对复分解反应熟悉的同学,一般能推出生成物,难度中等。
②HCO3- 。考察同学们对水解知识的理解,题目中特别指出将PH调高,HCO3-水解呈碱性。
③MnO2+2Fe2++4H+=== 2Fe3++Mn2++ 2H2O,难度中上,MnO2具有比较强的氧化性,而1mol的MnO2转移2mol的电子,其隐含信息就是还原产物为Mn2+,通过最终产物NH4Fe2(SO4) 2 (OH) 6可判断此时的Fe都是+3价,那原先的部分+2价Fe肯定是被MnO2氧化所致。
④
知识点
工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素。霾是由
空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾。
(1)SO2在烟尘的催化下形成硫酸的反应方程式是__________。
(2)NOx和SO2在空气中存在下列平衡:
2NO(g) + O2(g) 
2SO2(g) + O2 (g) 
SO2通常在二氧化氮的存在下,进一步被氧化,生成SO3。
① 写出NO2和SO2反应的热化学方程式为________。
② 随温度升高,该反应化学平衡常数变化趋势是________。
(3)提高2SO2 + O2
① T温度时,在1L的密闭容器中加入2.0 mol SO2和1.0 mol O2,5 min后反应达到
平衡,二氧化硫的转化率为50%,该反应的平衡常数是_______。
② 在①中条件下,反应达到平衡后,改变下列条件,能使SO2的转化率提高的是
_________(填字母)。
a.温度和容器体积不变,充入1.0 mol He
b.温度和容器体积不变,充入1.0 mol O2
c.在其他条件不变时,减少容器的体积
d.在其他条件不变时,改用高效催化剂
e. 在其他条件不变时,升高体系温度
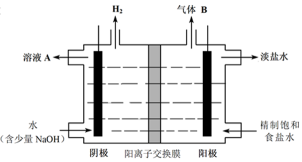
(4)工业上利用氯碱工业产品治理含二氧化硫的废气。下图是氯碱工业中电解饱和食盐水的原理示意图。
① 电解饱和食盐水的化学方程式是 。
② 用溶液A吸收含二氧化硫的废气,其反应的离子方程式是 。
③ 用含气体B的阳极区溶液吸收含二氧化硫的废气,其反应的离子方程式是
。
正确答案
见解析。
解析
(1) SO2 + H2O = H2SO3 2 H2SO3 + O2 2H2SO4
(2)① NO2(g) + SO2(g) = SO3(g) + NO(g) △H = -41.8 kJ·mol-1
② 减小
(3) ① 2
② b c
(4)① 2NaCl + 2H2O
② SO2 + OH- =HSO3- (或SO2 + 2OH- =SO32- + H2O)
③ SO2 + Cl2 + H2O =4H+ + SO42- + 2Cl-
知识点
扫码查看完整答案与解析