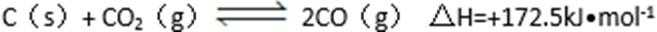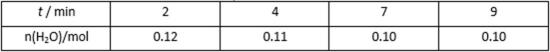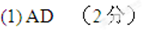- 化学平衡常数的含义
- 共77题
27.新的《环境空气质最标准》(GB3095-2012)将于2016年1月1日在我国全面实施。据此,环境空气质量指数(AQI)日报和实时报告包括了SO2、NO2、CO、O3、PM10、PM2.5等指标,为公众提供健康指引,引导当地居民合理安排出行和生活。
(1)汽车排出的尾气中含有CO和NO等气体,用化学方程式解释产生NO的原因____。
(2)汽车排气管内安装的催化转化器,可使汽车尾气中的主要污染物转化为无毒的大气循环物质。已知:
则反应
该反应的△S_____________0(填“>”、“<”或“=”)。
(3)将0.20molNO和0.10 molCO充入一个容积恒定为1L的密闭容器中,在不同条件下反应过程中部分物质的浓度变化状况如图所示。
①计算产物N2在6~9min时甲均反应速率v(N2)= ______mol·L-1·min-1;
②第12min时改变的反应条件为 ________(填“升温”、“降温”)
③计算反应在第24min时的平衡常数K=_________。若保持温度不变,再向容器中充入CO、N2各0.060mol,平衡将____移动(填“正向”、“逆向”或“不”)。
(4)环境监测中还可用沉淀法测定空气中含有较高浓度SO2的含量,经查得一些物质在20℃的数据如下表:
④吸收SO2最合适的试剂是___________[填“Ca(OH)2”或“Ba(OH)2”]溶液:
②在20℃时,向CaSO3悬浊液中滴加适最的BaCl7溶液,当CaSO3向BaSO3的转化达到平衡时,溶液中的
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28.工业上一般在密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g) 
(1)不同温度下的平衡转化率与压强的关系如图所示。
① 该反应ΔH________(填“>”或“<”,下同)0,ΔS________0,则该反应________(填“一定能”“一定不能”或“不一定”)自发进行。
② 实际生产条件控制在250℃、1.3×l04kPa左右,选择此压强的理由是( )。
(2)某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.1mol/L。
① 该反应的平衡常数K=( )。
② 在其他条件不变的情况下,将容器体积压缩到原来的1/2,与原平衡相比,下列有关说法正确的是( )(填字母)。
a. 氢气的浓度减少
b. 正反应速率加快,逆反应速率也加快
c. 甲醇的物质的量增加
d. 重新平衡时,n(H2)/n(CH3OH)增大
③ 若保持同一反应温度将起始物质改为amol CO、bmol H2、cmol CH3OH,欲使平衡混合物中各组成与原平衡相同,则a、b应满足的关系为____________________,且欲使开始时该反应向逆反应方向进行,c的取值范围是( )。
正确答案
(1)①<<不一定②该压强下,CO转化率已较高(90%左右),再增大压强,CO转化率提高不大,且生产成本增加
(2)① 6.25 ② bc ③ a+c=2和b+2c=6或b=2+2a1.8<c≤2
解析
解析已在路上飞奔,马上就到!
知识点
31. Ⅰ.已知:4Al(s)+3O2(g) = 2Al2O3(s) △H=-2834.9KJ•mol-1
写出铝与氧化铁发生铝热反应的热化学方程式( ) 。
Ⅱ.在2L密闭容器内,800℃时反应:
(1) 写出该反应的平衡常数表达式:K= ( ); 用

(2)下列研究目的和示意图相符的是( )。
III.科学家制造出一种使用固体电解质的高效燃料电池。一个电极通入空气,另一个电极通入燃料蒸汽。其中固体电解质是掺杂了


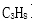
(1)电池的负极反应式为( );
(2)放电时固体电解质里的
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
13.N2O5是一种新型硝化剂,在一定温度下可发生下列反应:
下列说法不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
26. 碳及其化合物有广泛的用途。
(1)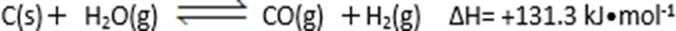
A.升高温度 B.增加碳的用量 C.加入催化剂 D.用CO吸收剂除去CO
(2)又知,
则
(3)CO与H2在一定条件下可反应生成甲醇,甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,该电池负极反应式为( ) 。
(4)在一定温度下,将CO(g)和H2O(g)各0.16 mol分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:



正确答案
解析
解析已在路上飞奔,马上就到!
知识点
26.(I)某氮肥厂氨氮废水中的氮元素多以NH4+和NH3·H2O的形式存在。在微生物作用下,NH4+经过两步反应被氧化成NO3-,两步反应的能量变化示意图如下:
(1)1molNH4+(aq)全部氧化成NO3-(aq)的热化学方程式是 ________。
(2)在一定条件下,向废水中加入CH3OH,将HNO3还原成N2,若该反应消耗32gCH3OH转移6mol电子,则参加反应的还原剂和氧化剂的物质的量之比是________。
(Ⅱ)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:
2NO+2CO
某温度下用气体传感器测得不同的时间的NO和CO浓度如下表:
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)在上述条件下反应能够自发进行,则反应的△H _____ 0(填写“>”、“<”、“=”)
(2)前2s内的平均反应速率v(N2)= ______;
(3)在该温度下,反应的平衡常数K= _______(只写出计算结果);
(4)某同学设计了三组实验,分别验证温度、催化剂比表面积对化学反应速率的影响规律,部分实验条件如下表:
该同学画出了表中三个实验条件下,混合气体中NO浓度随时间变化的趋势曲线图,请在图上标明各条曲线的实验编号;
(5)有人认为:催化剂比表面积增大,会提高NO和CO的反应效率,从而使污染物NO和CO的转化率提高。请用化学基本理论对此观点进行评价:________。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
26.一氧化碳是一种用途相当广泛的化工基础原料。
(1)利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍。
Ni(s)+4CO(g)
(2)在高温下一氧化碳可将二氧化硫还原为单质硫。已知:
(3)工业上一般采用CO与H2反应合成可再生能源甲醇,反应如下:
①某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应达到平衡后,测
得c(CO)=0.2mol·L-1,则CO的转化率为( )。
②合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,通过反应进行甲醇合成,T1℃下此反应的平衡常数为160。此温度下,在密闭容器中加入一定量CO和H2,反应到某时刻测得各组分的浓度如下:
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
选考题:请考生从给出的3道物理题、3道化学题、2道生物题中每科任选一题做答。
36.2012年4月15日,央视曝光河北一药用胶囊厂用皮革废料所生产明胶作原料。这些企业用生石灰处理皮革废料进行脱色漂白和清洗,随后熬制成工业明胶,卖给浙江新昌县药用胶囊生产企业,最终流向药品企业,进入消费者腹中。记者调查发现9家药厂的13个批次药品所用胶囊重金属铬含量超标。重铬酸钠俗称红矾钠(Na2Cr2O7·2H2O)是重要的化工产品和强氧化剂。工业制备的流程如下:
(1)化学上可将某些盐写成氧化物的形式,如Na2SiO3可写成Na2O·SiO2,则Fe(CrO2)2可写成( ) 。
(2)煅烧铬铁矿时,矿石中难溶的Fe(CrO2)2生成可溶于水的Na2CrO4,反应化学方程式如下:4Fe(CrO2)2+8Na2CO3+7O2= 2Fe2O3+8Na2CrO4+8CO2 为了加快该反应的反应速率,可采取的措施是( ) 。(写一种即可)
(3)已知CrO42-在不同的酸性溶液中有不同的反应,如:2CrO42-+2H+= Cr2O72-+H2O;
3CrO42-+4H+= Cr3O102-+2H2O① 往混合溶液甲中加入硫酸必须适量的原因是 ( ) 。
② 混合溶液乙中溶质的化学式是( ) 。
(4)在含Cr2O72-废水中存在着平衡:
,请写出该平衡的平衡常数表达式K=( ),若继续加水稀释,平衡将( )移动(填“正向”、“逆向”“不”)。
(5)请配平碱性溶液还原法中发生的离子反应:
□Cr2O72-+□S2-+□H2O - □Cr(OH)3+□S2O32-+□OH-
37.现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题.
(1)A的基态原子中能量最高的电子,其电子云在空间有 ( )个方向,原子轨道呈( )形。
(2)E2+的基态核外电子排布式为 ( ) 。
(3)A、B、C三种元素的最简单氢化物的熔点由低到高的顺序是( ) 。由B、C二种元素组成的分子与AC2互为等电子体的分子的结构式为 ( )。(用化学式表示)
(4)BD3 中心原子的杂化方式为 ( ),其分子空间构型为( ) 。
(5)用晶体的x射线衍射法对F的测定得到以下结果:F的晶胞为面心立方最密堆积(如右图),又知该晶体的密度为9.00g/cm3,晶胞中该原子的配位数为( );F的原子半径是( )cm;(阿伏加德罗常数为NA,要求列式计算)。
38.(15分)Grignard试剂(卤代烃基镁)广泛运用于有机合成中,Grignard试剂的合成方法是:

现以2-丁烯和必要的无机物为原料合成3,4-二甲基-3-己醇,进而合成一种分子式为C10H16O4的具有六元环的物质J,该物质具有对称性。合成线路如下:
请按要求填空:
(1)用系统命名法对物质B进行命名:( );
(2)在I-J过程中所加入的二元酸的结构简式为:( );
(3)反应①~⑧中属于取代反应的有( )个;属于消去反应的有 ( )个.
A.1个 B.2个 C.3个 D.4个
(4)写出下列过程的反应方程式(有机物请用结构简式表示):
B―→D ( );
I―→J ( ) ;
(5)写出一种满足以下条件的D的同分异构体的结构简式 ( ) 。
①能与Na反应反出H2;②核磁共振氢谱有四组峰;③有二种官能团。(注:羟基不能与碳碳双键中的碳原子直接相连)
36.2012年4月15日,央视曝光河北一药用胶囊厂用皮革废料所生产明胶作原料。这些企业用生石灰处理皮革废料进行脱色漂白和清洗,随后熬制成工业明胶,卖给浙江新昌县药用胶囊生产企业,最终流向药品企业,进入消费者腹中。记者调查发现9家药厂的13个批次药品所用胶囊重金属铬含量超标。重铬酸钠俗称红矾钠(Na2Cr2O7·2H2O)是重要的化工产品和强氧化剂。工业制备的流程如下:
(1)化学上可将某些盐写成氧化物的形式,如Na2SiO3可写成Na2O·SiO2,则Fe(CrO2)2可写成 。
(2)煅烧铬铁矿时,矿石中难溶的Fe(CrO2)2生成可溶于水的Na2CrO4,反应化学方程式如下:4Fe(CrO2)2+8Na2CO3+7O2 = 2Fe2O3+8Na2CrO4+8CO2 为了加快该反应的反应速率,可采取的措施是 。(写一种即可)
(3)已知CrO42-在不同的酸性溶液中有不同的反应,如:2CrO42-+2H+= Cr2O72-+H2O ;
3CrO42-+4H+= Cr3O102-+2H2O① 往混合溶液甲中加入硫酸必须适量的原因是 。
② 混合溶液乙中溶质的化学式是 。
(4)在含Cr2O72-废水中存在着平衡:Cr2O72-+H2O 
(5)请配平碱性溶液还原法中发生的离子反应:
□Cr2O72-+□S2-+□H2O - □Cr(OH)3+□S2O32-+□OH-37.现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题.
(1)A的基态原子中能量最高的电子,其电子云在空间有 个方向,原子轨道呈 形。
(2)E2+的基态核外电子排布式为 。
(3)A、B、C三种元素的最简单氢化物的熔点由低到高的顺序是 。由B、C二种元素组成的分子与AC2互为等电子体的分子的结构式为 。(用化学式表示)
(4)BD3 中心原子的杂化方式为 ,其分子空间构型为 。

38.(15分)Grignard试剂(卤代烃基镁)广泛运用于有机合成中,Grignard试剂的合成方法是:RX+Mg
现以2-丁烯和必要的无机物为原料合成3,4-二甲基-3-己醇,进而合成一种分子式为C10H16O4的具有六元环的物质J,该物质具有对称性。合成线路如下:
请按要求填
(1)用系统命名法对物质B进行命名: ;
(2)在I-J过程中所加入的二元酸的结构简式为: ;
(3)反应①~⑧中属于取代反应的有 个;属于消去反应的有 个.
A.1个 B.2个 C.3个 D.4个
(4)写出下列过程的反应方程式(有机物请用结构简式表示):
B―→D ;
I―→J ;
(5)写出一种满足以下条件的D的同分异构体的结构简式 。
①能与Na反应反出H2;②核磁共振氢谱有四组峰;③有二种官能团。(注:羟基不能与碳碳双键中的碳原子直接相连)
正确答案
正确答案
26.氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
(1)根据图1提供的信息,写出该反应的热化学方程式( ), 在图1中曲线( )(填“a” 或“b”)表示加入铁触媒的能量变化曲线。
(2)在恒容容器中,下列描述中能说明上述反应已达平衡的是( )
A.
B.单位时间内生成nmol N2的同时生成2nmolNH3
C.混合气体的密度不再改变
D.容器内压强不随时间的变化而变化
(3)一定温度下,向2L密闭容器中充入1molN2和3molH2,保持体积不变,0.5min后达到平衡,测得容器中有0.4mol NH3,则平均反应速率v(N2)=( ),该温度下的平衡常数K= ( )。 若升高温度,K值变化( )(填“增大”、“减小”或“不变”)。
(4)为了寻找合成NH3的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
A.请在下表空格中填入剩余的实验条件数据。
B.根据反应N2+ 3H2
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析