- 化学平衡常数的含义
- 共77题
8.研究CO2的利用对促进低碳社会的构建具有重要的意义。
I.已知某些化学键的键能数据如下
化学键 C=O C—O C—H H—H O—H
键能/kJ·mol-1 745 351 415 436 462
则CO2(g) + 3H2(g)
II.将燃煤废气中的CO2转化为二甲醚的反应原理为:
2CO2(g) + 6H2(g)
(1)该反应化学平衡常数表达式K = __________。
(2)已知在某压强下,该反应在不同温度、不同投料比时,达平衡时CO2的转化率如图所示
①该反应的ΔH __________ 0(填“>"或“<”)。
②若温度不变,减小反应投料比[n(H2)/n(CO2)],K值将__________(填“增大”、“减小”或“不变”)。
③700K投料比[n(H2)/n(CO2)] = 2时,达平衡时H2的转化率α = __________。
(3)某温度下,向体积一定的密闭容器中通入CO2(g)与H2(g)发生上述反应,下列物理量不再发生变化时,能说明反应达到平衡状态的是__________。
A.二氧化碳的浓度
B.容器中的压强
C.气体的密度
D.CH3OCH3与H2O的物质的量之比
(4)某温度下,在体积可变的密闭容器中,改变起始时加入各物质的量,在不同的压强下,平衡时CH3OCH3(g)的物质的量如下表所示:
①P1 __________ P3(填“>”“<”或“=”);
②X1 = __________;
③P2下,III中CH3OCH3的平衡转化率为__________。
正确答案
I. -184
II . (1)
(2) ①<
②不变
③ 45﹪
(3) ABC
(4) ① >
②0.05mol
③ 96﹪
解析
I.断裂旧的化学键需要吸收能量,形成新的化学键释放能量,根据反应CO2(g) + 3H2(g)


(2)①温度升高,CO2转化率降低,所以平衡逆向移动,正反应为放热反应,所以ΔH<0;
②K值只与温度有关,若温度不变,K值不变,所以K值将不变;
③700K时,投料比[n(H2)/n(CO2)] = 2可以判断出CO2转化率为30﹪,则参加反应的CO2为0.3,参与反应的H2为0.9,即转化率为0.9/2×100﹪=45﹪;
(3)A.二氧化碳的浓度不变,反应达到平衡状态B.由于反应前后气体系数不同,所以容器中的压强不变,反应达到平衡状态C.由于反应后有液体水产生,所以反应过程中气体质量发生变化,体积一定的密闭容器中的密度也发生变化,容器中的密度不变,反应达到平衡状态D.由反应方程式可以看出,CH3OCH3与H2O的物质的量之比始终为1:3.所以不能做平衡标志;
(4)① 根据反应2CO2(g) + 6H2(g)
②在体积可变的密闭容器中,I与II属于等效平衡,可以按照比例求解:2.0:1.0=0.1:X1,求解得到X1=0.05;
③P2下时,III中CH3OCH3的物质的量为0.04 mol,所以转化了0.96 mol,即转化率为96﹪。
考查方向
解题思路
I.断裂旧的化学键需要吸收能量,形成新的化学键释放能量,
II . (1) 化学平衡常数的书写要注意系数,同时液体或纯固体看作常数1;
(2) ①温度升高,CO2转化率降低,所以平衡逆向移动,反应为放热反应;
②K值只与温度有关,若温度不变,K值不变;
③700K时,投料比[n(H2)/n(CO2)] = 2可以判断出CO2转化率为30﹪,再根据H2与CO发生反应的比例关6:2进行计算;
(3) A.二氧化碳的浓度不变,反应达到平衡状态B.由于反应前后气体系数不同,所以容器中的压强不变,反应达到平衡状态C.由于反应后有液体水产生,所以反应过程中气体质量发生变化,体积一定的密闭容器中的密度也发生变化,容器中的密度不变,反应达到平衡状态D.由反应方程式可以看出,CH3OCH3与H2O的物质的量之比始终为1:3.所以不能做平衡标志;
(4) ① 根据反应2CO2(g) + 6H2(g)
②在体积可变的密闭容器中,I与II属于等效平衡,可以按照比例求解;
③P2下时,III中CH3OCH3的物质的量为0.04 mol ,所以转化了0.96 mol ,转化率为96﹪
易错点
不能准确判断化学键与焓变的关系致错,没有理解等效平衡的本质特点致错,解答中不
善于从图表中获取信息。
知识点
10.近年来,我国的雾霾问题引起政府和群众的高度关切,一般认为细颗粒物(即PM2.5,指直径小于或等于2.5微米的颗粒物)的指标与雾霾天气密切相关。与此同时,光化学烟雾也开始抬头,它是由非甲烷烃和NOx的排放引起的,严重时天空会出现彩色云雾,属于一种重污染现象。臭氧浓度升高是光化学烟雾形成的标志。请回答下列相关问题:
(1).以下可能引起细颗粒物指标变高的是 (填序号)。
a.燃煤取暖 b.大型交通设备 c.生活污水 d.火山喷发 e.局部战争 f.采矿业
(2).下图是某地光化学烟雾的日变化曲线:据图所示,上午8:00,非甲烷烃和NO出现峰值。 随后NO2约于10:00 达峰值,其主要反应的方程式可能为 。 8:00起,O3开始积累,并于13:00达峰值,O3积累与下列过程有关: O+O2 →O3,该反应物中游离的氧原子主要是由反应: 产生的。O3又使10:00前NO2的含量急剧增加,其化学方程式为 。你认为该地光化学烟雾较严重的时间最可能为 (填序号)。
a.8:00 b.10:00 c.15:00 d.20:00
(3).若25℃、101kPa下,气体的摩尔体积为24.5L/mol,此条件下向容器中充入一定量N2O4,当NO2 与N2O4的平衡混合物密度为3.18 g/L时,混合气体的平均摩尔质量为 ,N2O4的分解率(即转化率)为 。(计算结果均保留三位有效数字)。
(4).NO、NO2、NH4+及NO2-等被称为活性氮物质,超量排放会引起环境问题。NH4+与NO2-可发生下列反应:NH4+(aq)+NO2-(aq) 
据表知,将溶液稀释至原体积的2倍,反应速度将变为原来的 。
正确答案
(1) abdef
(2) 2NO+O2=2NO2 NO2=NO+O O3+NO=NO2+O2 c
(3) 77.9g/mol 18.1%
(4) 升温、增大反应物浓度 1/4
解析
(1)燃煤取暖、大型交通设备、火山喷发、局部战争、采矿业可能引起细颗粒物指标变高,故选abdef。
(2) NO和氧气反应生成的NO2约于10:00 达峰值,其主要反应的方程式可能为2NO+O2=2NO2。
8:00起,O3开始积累,并于13:00达峰值,NO2明显减少,O3积累与NO2有关: O+O2 →O3,该反应物中游离的氧原子主要是由反应NO2=NO+O产生的。
O3又使10:00前NO2的含量急剧增加,其化学方程式为O3+NO=NO2+O2。
臭氧浓度升高是光化学烟雾形成的标志,该地光化学烟雾较严重的时间最可能为15:00,故选c。
(3)若25℃、101kPa下,气体的摩尔体积为24.5L/mol,此条件下向容器中充入一定量N2O4,当NO2 与N2O4的平衡混合物密度为3.18 g/L时,混合气体的平均摩尔质量为3.18 g/L×24.5L/mol=77.9g/mol;
假设N2O4的物质的量为1mol,N2O4的分解率(即转化率)为x
N2O4 = 2NO2
1mol 0
(1-x) mol 2x mol
92g/((1-x) mol+2x mol)=77.9g/mol x=18.1%,N2O4的分解率(即转化率)为18.1%。
(4)将相关实验数据带入ν =k·c(NH4+)x·c(NO2-)y,可得x=1,y=1,k=2.7×10-4,将溶液稀释至原体积的2倍,c(NH4+)和c(NO2-)变为原来的1/2,反应速度将变为原来的1/4。
考查方向
解题思路
(1)燃煤取暖、大型交通设备、火山喷发、局部战争、采矿业可能引起细颗粒物指标变高。
(2)NO和氧气反应生成的NO2约于10:00 达峰值,其主要反应的方程式可能为2NO+O2=2NO2。
8:00起,O3开始积累,并于13:00达峰值,NO2明显减少,O3积累与NO2有关: O+O2 →O3,该反应物中游离的氧原子主要是由反应NO2=NO+O产生的。
O3又使10:00前NO2的含量急剧增加,其化学方程式为O3+NO=NO2+O2。
臭氧浓度升高是光化学烟雾形成的标志,该地光化学烟雾较严重的时间最可能为15:00。
(3)若25℃、101kPa下,气体的摩尔体积为24.5L/mol,此条件下向容器中充入一定量N2O4,当NO2 与N2O4的平衡混合物密度为3.18 g/L时,混合气体的平均摩尔质量为3.18 g/L×24.5L/mol=77.9g/mol;
假设N2O4的物质的量为1mol,N2O4的分解率(即转化率)为x
N2O4 = 2NO2
1mol 0
(1-x) mol 2x mol
92g/((1-x) mol+2x mol)=77.9g/mol x=18.1%,N2O4的分解率(即转化率)为18.1%。
(4)将相关实验数据带入ν =k·c(NH4+)x·c(NO2-)y,可得x=1,y=1,k=2.7×10-4,将溶液稀释至原体积的2倍,c(NH4+)和c(NO2-)变为原来的1/2,反应速度将变为原来的1/4。
易错点
本题解题的关键是第(4)题,通过计算先求出相关未知数的值。
知识点
7.向容积固定为2L的密闭容器中充入9.6mol NO和4.8mol O2,发生如下反应:
①2NO(g)+O2 (g)

测得NO2和N2O4的浓度变化如图所示,0~10min维持容器温度为T℃,10min时改变某反应条件,一段时间后再次平衡。下列说法正确的是( )
正确答案
解析
A、前5min反应的平均速率v(NO)可以根据 NO2浓度的变化量进行计算,v(NO)=v(NO2)=(1.2+2×0.8)÷5=0.56mol·(L·min)-1,错误;
B、T1℃时反应①的化学平衡常数可以根据平衡时浓度进行计算,K=1.22÷(2.02×1.0)=0.36,正确;
C、10min时 NO2和 N2O4浓度都发生了变化,所以不可能是降低温度应该为增大体积,错误;
D、将1.6mol NO2和4.0mol N2O4完全转化为NO和 O2,得到9.6molNO和4.8molO2,此时反应与原反应等效平衡,T℃达到平衡时,NO2的物质的量浓度与图中5~10min的相同,错误。
考查方向
解题思路
A、前5min反应的平均速率v(NO)可以根据 NO2浓度的变化量进行计算;
B、T1℃时反应①的化学平衡常数可以根据平衡时浓度进行计算;
C、10min时 NO2和 N2O4浓度都发生了变化,所以不可能是降低温度应该为增大体积;
D、此时反应与原反应等效平衡。
易错点
A.用NO2计算v(NO)时忽略转化为N2O4的NO2
B.计算化学平衡常数时将转化为N2O4的NO2计算在内
C.不能正确判断外界条件对平衡的影响
D、不能准确判断此时反应与原反应为等效平衡关系。
知识点
10.已知电离平衡常数:H2CO3>HClO>HCO。下列离子反应方程式正确的是
①NaClO溶液中通入少量二氧化碳:2ClO-+CO2+H2O === 2HClO+CO
②Na2CO3溶液中加入HClO溶液:CO+HClO === HCO+ClO-
③等物质的量的Cl2与Na2CO3溶液恰好反应:Cl2+CO+H2O === HCO+Cl-+HClO
④Cl2通入NaHCO3溶液中:Cl2+2HCO=== 2CO2↑+Cl-+ClO-+H2O
正确答案
解析
强酸制取弱酸,据此作答:
①NaClO溶液中通入少量二氧化碳生成碳酸氢钠:ClO-+CO2+H2O === HClO+HCO3-,错误;
②Na2CO3溶液中加入HClO溶液:CO32-+HClO === HCO3-+ClO-,正确;
③等物质的量的Cl2与水反应生成盐酸和次氯酸,盐酸和Na2CO3溶液生成碳酸氢钠:Cl2+CO32-+H2O = HCO3-+Cl-+HClO,正确;
④Cl2通入NaHCO3溶液中:Cl2 + HCO3-= CO2↑+Cl-+HClO,错误。
故选C。
考查方向
解题思路
①NaClO溶液中通入少量二氧化碳生成碳酸氢钠:ClO-+CO2+H2O === HClO+HCO3-;
②Na2CO3溶液中加入HClO溶液:CO32-+HClO === HCO3-+ClO-;
③等物质的量的Cl2与水反应生成盐酸和次氯酸,盐酸和Na2CO3溶液生成碳酸氢钠;
④Cl2通入NaHCO3溶液中:Cl2 + HCO3-= CO2↑+Cl-+HClO。
易错点
本题考查与反应物量相关的离子方程式的书写,明确不同量时具体发生的反应是书写离子方程式的关键,难度较大。
知识点
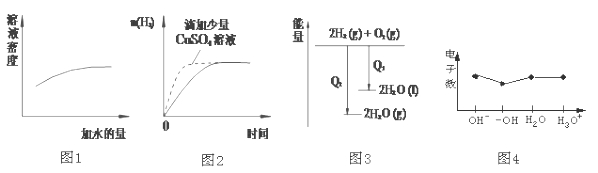
9.下列图像表达正确的是( )
正确答案
解析
A、硫酸溶液的浓度越小密度越小,随着加水量的增加,硫酸的浓度逐渐减小,密度逐渐减小,与图像不符;
B、等量的锌与过量盐酸反应,滴加少量硫酸铜溶液后,有少量锌与硫酸铜反应置换出铜形成原电池,反应速率加快,生成氢气的量减少,与图像不符;
C、气态水转化为液态水为放热过程,氢气与氧气反应生成液态水比生成气态水放出的热量多,与图像不符;
D、OH-、H2O、H3O+均为10电子微粒,—OH含有9个电子,与图像相符。
考查方向
解题思路
A、硫酸溶液的浓度越小密度越小;
B、滴加少量硫酸铜溶液后,有少量锌与硫酸铜反应置换出铜形成原电池;
C、气态水转化为液态水为放热过;
D、OH-、H2O、H3O+均为10电子微粒。
易错点
10电子微粒。
知识点
扫码查看完整答案与解析