- 有关反应热的计算
- 共34题
氨在国民经济中占有重要地位。
(1)合成氨工业中,合成塔中每产生2 mol NH3,放出92.2 kJ热量。
① 工业合成氨的热化学方程式是________。
② 若起始时向容器内放入2 mol N2和6 mol H2,达平衡后放出的热量为Q,则
Q(填“>”、“<”或“=”)_______184.4 kJ。
③ 已知:
1 mol N-H键断裂吸收的能量约等于_______kJ。
(2)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3 (g)+ CO2 (g) 
①焓变ΔH(填“>”、“<”或“=”)___________ 0
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)
③ 上图中的B点处,NH3的平衡转化率为_______。
(3)氮气是制备含氮化合物的一种重要物质,而氮的化合物用途广泛。
下面是利用氮气制备含氮化合物的一种途径:
①过程Ⅱ的化学方程式是___________ 。
②运输时,严禁NH3与卤素(如Cl2)混装运输。若二者接触时剧烈反应产生白烟,并且0.4 mol NH3参加反应时有0.3 mol 电子转移。写出反应的化学方程式___________ 。
③氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。
已知:4NH3(g) + 3O2(g) == 2N2(g) + 6H2O(g) ΔH = ―1316 kJ/mol,则该燃料电池的负极反应式是___________ 。
正确答案
见解析。
解析
(1)① N2(g)+3H2(g) =2NH3(g) ΔH= –92.2 kJ/mol
② <
③391
(2)① <
②nNH3增大,平衡正向移动,则增大CO2的转化率
③32%
(3)① N2 + 3H2
② 8NH3 + 3Cl2 == 6NH4Cl + N2
③ 2NH3―6e- + 6OH- == N2↑+ 6H2O
知识点
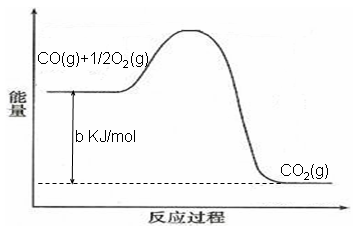
某一化学反应在不同条件下的能量变化曲线如右图所示。下列说法正确的是()
正确答案
解析
略
知识点
29.盐酸是重要的化工原料。工业上利用氢气与氯气反应制盐酸。回答下列问题
(1)氢气在氯气中燃烧的现象为( )。
(2)已知:
H2(g)的燃烧热为( ) 。断裂1 mol H—H键、Cl—Cl键需吸收的能量分别为436 kJ、242.8kJ,则断裂1 mol H—Cl键需吸收的能量为( )kJ。
(3)制取盐酸的原料氢气和氯气工业上通过氯碱工业制得。图是氯碱工业的原理示意图(阳离子交换膜只允许阳离子通过)。
①电解食盐水的化学方程式为( )
②图中,石墨接电源( ) 极,电解时铁电极的电极反应为 ( ),电解过程中通过离子交换膜的主要离子是( ) 。
(4)实验室利用二氧化锰跟浓盐酸反应制取氯气,反应的化学方程式是( ) 。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
23.(1)M由两种短周期元素组成,每个M分子含有18个电子,其分子球棍模型如右图所示。测得M的摩尔质量为32g/mol。画出编号为2的原子结构示意图:( )。
(2)已知1.0mol·L—1NaHSO3溶液的pH为3.5,加入氯水,振荡后溶液pH迅速降低。溶液pH降低的原因是 ( ) (用离子方程式表示)。
(3)在常温常压和光照条件下,N2在催化剂(TiO2)表面与H2O反应,生成1molNH3和O2时的能量变化值为382.5kJ,达到平衡后此反应NH3生成量与温度的实验数据如下表。则该反应的热化学方程式为 ( ) 。
(4)在溶液中,一定浓度的NH4+能溶解部分Mg(OH)2固体,反应如下:
2NH4+(aq) + Mg(OH)2(s) Mg2+(aq)+2NH3·H2O(aq) 写出上述反应的平衡常数表达式( );某研究性学习小组为探究Mg2+与NH3·H2O反应形成沉淀的情况,设计如下两组实验
请分析实验①、②产生不同现象的原因:( )。
(5) 在室温下,化学反应I–(aq)+ ClO–(aq) = IO–(aq) + Cl–(aq)的反应物初始浓度、溶液中的氢氧根离子初始浓度及初始速率间的关系如下表所示:
已知表中初始反应速率与有关离子浓度关系可以表示为v= k [I–]1 [ClO–]b [OH–]c(温度一定时,k为常数)。
①设计实验2和实验4的目的是( ) ;
②若实验编号4的其它浓度不变,仅将溶液的酸碱值变更为pH = 13,反应的初始速率v= ( ) 。
23.

(2)已知1.0mol·L—1NaHSO3溶液的pH为3.5,加入氯水,振荡后溶液pH迅速降低。溶液pH降低的原因是 (用离子方程式表示)。
(3)在常温常压和光照条件下,N2在催化剂(TiO2)表面与H2O反应,生成1molNH3和O2时的能量变化值为382.5kJ,达到平衡后此反应NH3生成量与温度的实验数据如下表。则该反应的热化学方程式为 。
(4)在溶液中,一定浓度的NH4+能溶解部分Mg(OH)2固体,反应如下:
2NH4+(aq) + Mg(OH)2(s) 
写出上述反应的平衡常数表达式
某研究性学习小组为探究Mg2+与NH3·H2O反应形成沉淀的情况,设计如下两组实验
请分析实验①、②产生不同现象的原因:
。
(5) 在室温下,化学反应I–(aq)+ ClO–(aq) = IO–(aq) + Cl–(aq)的反应物初始浓度、溶液中的氢氧根离子初始浓度及初始速率间的关系如下表所示:
已知表中初始反应速率与有关离子浓度关系可以表示为v= k [I–]1 [ClO–]b [OH–]c(温度一定时,k为常数)。
①设计实验2和实验4的目的是 ;
②若实验编号4的其它浓度不变,仅将溶液的酸碱值变更为pH = 13,反应的初始速率v= 。
正确答案
29.中科院大气研究所研究员张仁健课题组与同行合作,对北京地区PM2.5化学组成及来源的季节变化研究发现,北京PM2.5有6个重要来源,其中,汽车尾气和燃煤分别占4%、18%
(1)用于净化汽车尾气的反应为:
A.装有尾气净化装置的汽车排出的气体中不再含有NO或CO
B.提高尾气净化效率的常用方法是升高温度
C.增大压强,上述平衡右移,故实际操作中可通过增压的方式提高其净化效率
D.提高尾气净化效率的最佳途径是使用高效催化剂
(2)CO对人类生存环境的影响很大,CO治理问题属于当今社会的热点问题。镍与CO反应的化学方程式为
则用SO2除去CO的热化学方程式为_____________________________________。
(3)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。发生的化学反应是: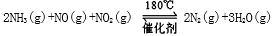
(4)利用ClO2 氧化氮氧化物反应过程如下: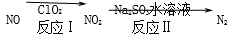

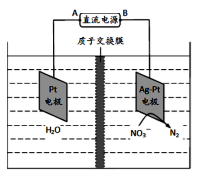
(5)化学在环境保护中起着十分重要的作用,电化学降解法可用于治理水中硝酸盐的污染。其原理如下图所示。
电源负极为( )(填A或B),阴极反应式为( );若电解过程中转移了2mol电子,则质子交换膜左侧极室电解液的质量减少( )克。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析