- 氮族元素简介
- 共57题
9.等物质的量的下列物质在一定条件下与足量浓硝酸反应生成N02,消耗硝酸的物质的量最多的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
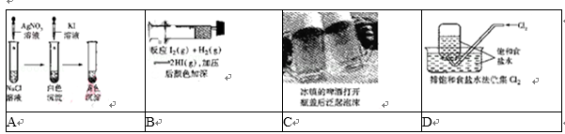
3.下列事实不能用平衡移动原理解释的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
17.镁合金是重要的民用和航空材料,镁作为一种强还原剂,还用于钛、镀和铀的生产,氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等。
(1)氧化镁的电子式为_________。
(2)写出镁与TiCl4在高温条件下制取钛的化学方程式:_________。
(3)从海水中提取金属镁用到的主要化学药品有_______。
(4)某研究小组同学在实验室用卣块制备少量Mg(ClO3)2.6H2O,其流程如下:
已知:I卤块主要成分为MgCl2.6H2O,含有MgSO4、FeCl2等杂质
Ⅱ 可选用的试剂:H2O2,稀硫酸、KMnO4溶液、MgCl2溶液、MgO.
①加入BaCl2溶液的目的是_________.
②步骤X中需将Fe2+转化为Fe3+,所选的试剂为____________.
③Mg(ClO3)2加入到含有KSCN的FeSO4酸性溶液中立即出现红色,写出相关反应的离子方程式:_________.
正确答案
(1)
(2)2Mg+TiCl4
(3)石灰乳(或石灰石、生石灰)、盐酸
(4)除去SO42 ;H2O2 ;ClO3﹣+6Fe2++6H+═6Fe3++Cl﹣+3H2O、Fe3++SCN﹣=Fe(SCN)3
解析
解析已在路上飞奔,马上就到!
知识点
2.下列叙述正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
某化学课外活动小组通过实验研究NO2的性质.
已知:2NO2 + 2NaOH=== NaNO3 + NaNO2 + H2O
任务1:利用下图所示装置探究NO2能否被NH3还原(K1、K2为止水夹,夹持固定装置略去).
21.E装置中制取NO2反应的化学方程式是 .
22.若NO2能够被NH3还原,预期观察到C装置中的现象是 .
23.实验过程中,未能观察到C装置中的预期现象.该小组同学从反应原理的角度分析了原因,认为可能是:
①NH3还原性较弱,不能将NO2还原;
②在此条件下,NO2的转化率极低;
③ .
24.此实验装置存在一个明显的缺陷是 .
25.任务2:探究NO2能否与Na2O2发生氧化还原反应.
实验前,该小组同学提出三种假设.
假设1:二者不反应;
假设2:NO2能被Na2O2氧化;
假设3: .
26.为了验证假设2,该小组同学选用任务1中的B、D、E装置,将B中的药品更换为Na2O2,另选F装置(如右图所示),重新组装,进行实验.
①装置的合理连接顺序是(某些装置可以重复使用) .
②实验过程中,B装置中淡黄色粉末逐渐变成白色.经检验,该白色物质为纯净物,且无其他物质生成.推测B装置中反应的化学方程式为 .
正确答案
Cu + 4HNO3 (浓) === Cu(NO3)2 + 2NO2↑+ 2H2O
解析
浓硝酸和铜反应生成硝酸铜、二氧化氮和水,反应方程式为:Cu+4HNO3 (浓)═Cu(NO3)2+2NO2↑+2H2O,故答案为:Cu+4HNO3 (浓)═Cu(NO3)2+2NO2↑+2H2O;
考查方向
解题思路
若NO2能够被NH3还原,则混合气体的颜色将变浅;
易错点
1、实验过程分析。
2、本题考查了氮及其化合物性质分析判断。
正确答案
C装置中混合气体颜色变浅(其他合理答案也可)
解析
二氧化氮是红棕色气体,如果能被氨气还原,生成无色气体氮气,则C装置中混合气体颜色变浅,故答案为:C装置中混合气体颜色变浅;
考查方向
解题思路
实验过程中,未能观察到C装置中的预期现象,说明二氧化氮反应的量很少,可能是反应速率降低,或者二氧化氮的转化率较低;
易错点
1、实验过程分析。
2、本题考查了氮及其化合物性质分析判断。
正确答案
在此条件下,该反应的化学反应速率极慢。
解析
造成未能观察到C装置中的预期现象可能原因是:在此条件下,该反应的化学反应速率极慢或NO2的转化率极低导致反应现象变化不明显,故答案为:在此条件下,该反应的化学反应速率极慢;
考查方向
解题思路
铜和浓硝酸反应生成硝酸铜,二氧化氮和水,依据反应写出离子方程式;
二氧化氮是红棕色气体,如果能被氨气还原,生成无色气体氮气,则C装置中混合气体颜色变浅;造成未能观察到C装置中的预期现象可能原因是:在此条件下,该反应的化学反应速率极慢或NO2的转化率极低导致反应现象变化不明显;铜和浓硝酸反应生成硝酸铜,二氧化氮和水,反应写出离子方程式为;Cu+4H++2NO3-=Cu2++2NO2↑+2H2O;
易错点
1、实验过程分析。
2、本题考查了氮及其化合物性质分析判断。
正确答案
缺少尾气吸收装置
解析
二氧化氮是有毒气体,氨气是有刺激性气味的气体,所以都不能直接排空,要进行尾气处理才能排空,故答案为:缺少尾气吸收装置;
考查方向
本题主要考查了氮的氧化物的性质及其对环境的影响;性质实验方案的设计.
易错点
1、实验过程分析。
2、本题考查了氮及其化合物性质分析判断。
正确答案
NO2能被Na2O2还原(其他合理答案也可)
解析
Na2O2中O为-1价,可以被NO2氧化,也可以被Na2O2还原,
故答案为:NO2能被Na2O2还原;
考查方向
易错点
1、实验过程分析。
2、本题考查了氮及其化合物性质分析判断。
正确答案
① EDBDF或EDBF ;
② 2NO2 + Na2O2 === 2NaNO3
解析
验证过氧化钠和二氧化氮反应,首先要用E装置制取二氧化氮,因为制取的二氧化氮气体中含有水蒸气,水能和过氧化钠反应而造成干扰,所以要用D装置除去水蒸气,然后较纯净的二氧化氮通过B装置,未反应的二氧化氮有毒不能直接排空,所以最后要进行尾气处理,选用图2装置处理尾气,所以装置的合理连接顺序是EDBDF或EDBF;B装置中淡黄色粉末逐渐变成白色.经检验,该白色物质为纯净物,且无其他物质生成,过氧化钠作氧化剂,则二氧化氮中氮元素失电子化合价升高而作还原剂,所以氮元素只能转化为+5价,且生成物是纯净物,所以是硝酸钠,反应方程式为2NO2+Na2O2═2NaNO3,故答案为:EDBDF或EDBF; 2NO2+Na2O2═2NaNO3.
考查方向
本题主要考查了氮的氧化物的性质及其对环境的影响;性质实验方案的设计.
易错点
1、实验过程分析。
2、本题考查了氮及其化合物性质分析判断。
扫码查看完整答案与解析