- 氮族元素简介
- 共57题
回答下列问题。
18.Ⅰ.工业上用电解饱和食盐水制取烧碱和氯气。用于电解的食盐水需要先除去其中的Ca2+、Mg2+、SO42-等离子。其除杂操作时,往粗盐水中先加入过量的 (填化学式),至沉淀不再产生后,再加过量的Na2CO3和NaOH,充分反应后沉淀后将沉淀一并滤去。经过检测发现滤液中仍然含有一定量的SO42-,其原因是 。
[已知:

19.(1)向含SO42-、CO32-等的溶液中滴加BaCl2溶液,当BaCO3开始沉淀时,溶液中
(2)已知:重晶石(BaSO4)高温煅烧可发生一系列反应,其中部分反应如下:
BaSO4(s)+4C(s)
BaS(s)

2C(s)+O2(g)
则Ba(s)+S(s)+2O2(g)
20.Ⅲ.工业尾气SO2有多种吸收和处理方法。
(1)亚硫酸钠吸收法写出Na2SO3溶液汲收SO2的离子方程式 。
(2)电化学处理法
①如图所示,Pt(1)电极的反应式为 。
②当电路中转移0.02mole-时(较浓H2SO4尚未排出),交换膜左侧溶液中约增加 mol离子。
正确答案
Ⅰ BaCl2;
BaSO4和BaCO3的Ksp相差不大,当向溶液中加入大量CO32―时,一部分BaSO4(s)转化为BaCO3(s),BaSO4(s)+CO32―(aq)
解析
Ⅰ工业上用电解饱和食盐水制取烧碱和氯气。用于电解的食盐水需要先除去其中的Ca2+、Mg2+、SO42-等离子。其除杂操作时,往粗盐水中先加入过量的BaCl2,至沉淀不再产生后,再加过量的Na2CO3和NaOH,充分反应后沉淀后将沉淀一并滤去。经过检测发现滤液中仍然含有一定量的SO42-,BaSO4和BaCO3的Ksp相差不大,当向溶液中加入大量CO32―时,一部分BaSO4(s)转化为BaCO3。
考查方向
解题思路
BaSO4和BaCO3的Ksp相差不大。
正确答案
(1)0.0216
(2)-1473.2kJ/mol
解析
(1)向含SO42-、CO32-等的溶液中滴加BaCl2溶液,当BaCO3开始沉淀时,溶液中
(2)已知:BaSO4(s)+4C(s)
BaS(s)

2C(s)+O2(g)
则Ba(s)+S(s)+2O2(g)
考查方向
解题思路
(1)向含SO42-、CO32-等的溶液中滴加BaCl2溶液,当BaCO3开始沉淀时,溶液中
(2)已知:BaSO4(s)+4C(s)
BaS(s)

2C(s)+O2(g)
则Ba(s)+S(s)+2O2(g)
易错点
BaSO4和BaCO3的Ksp判断、盖斯定律的计算、Pt(1)电极的反应式的书写。
正确答案
(1)SO32-+SO2+H2O
(2)①
解析
(1)亚硫酸钠吸收法,Na2SO3溶液汲收SO2的离子方程式SO32-+SO2+H2O
(2)①如图所示,Pt(1)电极的反应式为①
②当电路中转移0.02mole-时(较浓H2SO4尚未排出),交换膜左侧溶液中约增加0.03mol 离子。
考查方向
解题思路
(1)亚硫酸钠吸收法,Na2SO3溶液汲收SO2的离子方程式SO32-+SO2+H2O
(2)①如图所示,Pt(1)电极的反应式为①
②当电路中转移0.02mole-时(较浓H2SO4尚未排出),交换膜左侧溶液中约增加0.03mol 离子。
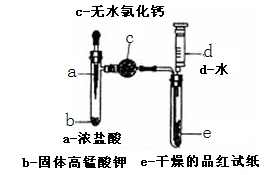
某化学实验小组为探究氯气漂白原理,设计了以下实验装置:
8.将a中浓盐酸挤入试管中,发生反应的化学方程式为 。
9.仪器c的名称为 ,其中固体也可用 代替。
10.当试管e中充满黄绿色气体时,观
11.注射器在实验中除了可向试管e中加水,还有 的作用。
正确答案
(1)2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。
解析
(1)a中是浓盐酸与高锰酸钾反应制取氯气,化学方程式是2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。
考查方向
解题思路
依据氯气的性质及其漂白实验设计解题。
正确答案
(2)干燥管;P2O5或硅胶一般不用无水CuSO4。
解析
(2)仪器c是球形干燥管——目的是吸收水蒸气,以获得干燥的氯气、并通过干燥的品红试纸检验氯气有无漂白性;氯气与碱性干燥剂反应,所以只要是酸性或中性干燥剂,如P2O5或硅胶也可以。
考查方向
解题思路
依据氯气的性质及其漂白实验设计解题。
正确答案
(3)没有;有;干燥的氯气不能使品红试纸褪色,氯气溶于水后,和水反应能生成HClO具有强氧化性,能使品红试纸褪色。
解析
(3)当试管e中充满黄绿色气体时,e中的品红试纸不变色,说明干燥的氯气无漂白性;再将注射水入e后,品红试纸褪色,说明是生成的HClO有漂白性。由此得出的结论是:干燥的氯气不能使品红试纸褪色,氯气溶于水后,生成具有强氧化性的HClO,能使品红试纸褪色。
考查方向
解题思路
依据氯气的性质及其漂白实验设计解题。
正确答案
(4)反应结束后,可向上拉针栓,从试管中抽出氯气,起到储存多余氯气的作用,防止氯气的污染。
解析
(4)反应结束后,可向上拉针栓,从试管中抽出氯气,起到储存多余氯气的作用,防止氯气的污染。
考查方向
解题思路
依据氯气的性质及其漂白实验设计解题。
易错点
(4)注射器在实验中除了可向试管e中加水,还有的作用?。
为了预防碘缺乏症,国家规定每千克食盐中应含有40~50 mg碘酸钾。碘酸钾晶体具有较高的稳定性,但在酸性溶液中,碘酸钾是一种较强的氧化剂,能跟某些还原剂反应生成碘;在碱性溶液中,碘酸钾能被氯气、次氯酸等更强的氧化剂氧化为更高价的碘的含氧酸盐。工业生产碘酸钾的流程如图所示。
8.碘在周期表中的位置为__________________;
9.碘、氯酸钾、水混合反应时,若两种还原产物所得电子的数目相同,请配平该反应的化学方程式:____I2+____KClO3+____H2O=____KH(IO3)2+____KCl+____Cl2↑;
10.混合反应后,用稀酸酸化的作用是___________________________,在稀盐酸和稀硝酸中不能选用的酸是_________,理由是__________________________________;
11.试剂X的化学式为__________,写出用试剂X调pH的化学方程式__________________;
12.如果省略“酸化”、“逐氯”、“结晶①、过滤”这三步操作,直接用试剂X调整反应混合物的pH,对生产碘酸钾有什么影响?________________________________________。
正确答案
(1)第五周期 第ⅦA族
解析
(1)I属于卤族元素,在周期表中的位置为第五周期 第ⅦA族。
考查方向
解题思路
充分审题把握与解题有关的信息,如有关用盐酸还是硝酸的问题,由题中所给的信息碘酸钾是一种较强的氧化剂,就要注意不能用盐酸了。
易错点
处理信息不当,知识的迁移、演绎能力不足。
正确答案
(2)6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑
解析
(2)反应中I由0价升高到+5价,Cl由+5价降到0价与-1价。利用得失电子守恒,可得到正确答案。
考查方向
解题思路
充分审题把握与解题有关的信息,如有关用盐酸还是硝酸的问题,由题中所给的信息碘酸钾是一种较强的氧化剂,就要注意不能用盐酸了。
易错点
处理信息不当,知识的迁移、演绎能力不足。
正确答案
(3)促进氯气从反应混合物中逸出 稀盐酸盐酸能还原已生成的碘酸氢钾
解析
(3)由(2)中的反应可知反应过程中会产生氯气,用酸酸化能降低氯气在混合液中的溶解,有利于氯气从混合液中逸出。由信息可知生成的碘酸氢钾具有很强的氧化性,由于盐酸是一种有还原性的酸,二者混合会发生反应。
考查方向
解题思路
充分审题把握与解题有关的信息,如有关用盐酸还是硝酸的问题,由题中所给的信息碘酸钾是一种较强的氧化剂,就要注意不能用盐酸了。
易错点
处理信息不当,知识的迁移、演绎能力不足。
正确答案
(4)KOH KH(IO3)2+KOH=2KIO3+H2O
解析
(4)加入氢氧化钾是将反应中生成的KH(IO3)2转变成KIO3,反应方程式为KH(IO3)2+KOH=2KIO3+H2O
考查方向
解题思路
充分审题把握与解题有关的信息,如有关用盐酸还是硝酸的问题,由题中所给的信息碘酸钾是一种较强的氧化剂,就要注意不能用盐酸了。
易错点
处理信息不当,知识的迁移、演绎能力不足。
正确答案
(5)反应产生的氯气能与氢氧化钾溶液反应生成KClO,KClO能将KIO3氧化成KIO4,从而不能得到碘酸钾
解析
(5)如没有“酸化”、“逐氯”、“结晶①、过滤”这三步操作反应产生的氯气能与氢氧化钾溶液反应生成KClO,KClO能将KIO3氧化成KIO4,从而不能得到碘酸钾
考查方向
解题思路
充分审题把握与解题有关的信息,如有关用盐酸还是硝酸的问题,由题中所给的信息碘酸钾是一种较强的氧化剂,就要注意不能用盐酸了。
易错点
处理信息不当,知识的迁移、演绎能力不足。
5. 下列叙述正确的是( )
正确答案
解析
A. CH3COONa的水解显碱性,溶液中c(OH-) >c(H+),故错误;
B. Na2CO3溶液加水稀释,越稀越水解,但是加水使溶液体积增大得多,而水解生成的OH-增大得少,故c(OH-)降低,pH减小,选项错误;
C. 一定温度下,pH=6的HCl溶液和pH=6的NH4Cl溶液中,c(H+)相等是正确的;
D. 在Na2S溶液中加入AgCl固体,会出现沉淀的转化——AgCl转化为溶度积更小的Ag2S,溶液中c(S2-)会发生变化,故选项错误。
考查方向
解题思路
依据电离平衡、水解平衡、溶度积等原理解题。
易错点
易错选B。
知识点
6.已知:含碳碳双键的物质一定条件下能与水发生加成反应生成醇,有机物A—D间存在图示的转化关系。下列说法不正确的是 ()
正确答案
解析
由C经催化氧化得到乙酸,可以推断出A为乙烯,B为乙醇,D为乙酸乙酯。乙烯能被高锰酸钾氧化,使其褪色,A正确。因为酒精与水可以互溶,所以不能用它碘水中的碘单质,B错误。乙醇与乙酸发生的酯化化反应也是取代反应中的一种类型,C正确。乙酸乙酯的结构简式为:C
考查方向
解题思路
本题比较简单,从C被氧化成乙酸进行突破,再推出其它物质,得到正确结论。
易错点
有机知识记忆不清
知识点
扫码查看完整答案与解析