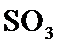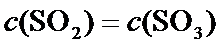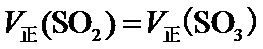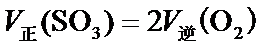- 氮族元素简介
- 共57题
11.熔融碳酸盐燃料电池是一种高温电池,具有效率高、噪音低、无污染、燃料多样化、余热利用价值高和电池构造材料价廉等诸多优点,是未来的绿色电站。某种熔融碳酸盐燃料电池以Li2CO3.K2CO3为电解质.以CH4为燃料时,该电池工作原理见下图。下列说法正确的是( )
正确答案
考查方向
解题思路
该原电池为甲烷燃料电池,通入燃料的电极为负极.通入氧化剂的电极为正极,负极反应式为CH4+4CO32--8e-=5CO2+2H2O,正极反应式为O2+2CO2+4e-═2CO32-,负极上产生的二氧化碳可以为正极所利用,所以A是负极,B是正极。
【解析】A.燃料电池中通入燃料的电极是负极.通入氧化剂的电极是正极,原电池放电时,阳离子向正极移动,Li+.K+移向右侧电极移动,故A错误;
B.外电路中电子由负极流向正极,即从左侧电极移向右侧电极,故B错误;
C.负极反应式为CH4+4CO32--8e-=5CO2+2H2O,正极反应式为O2+2CO2+4e-═2CO32-,通入1mol气体甲烷气时,左侧电极上生成5 molCO2,故C正确;
D.相同条件下通入气体B与气体C的体积比为1:2,故D错误.
故选C。
易错点
电子流向不清楚,充放电原理混淆
知识点
化学反应原理在科研和生产中有广泛应用 .
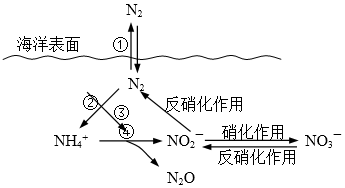
8.Ⅰ.氮元素在海洋中的循环,是整个海洋生态系统的基础和关键。海洋中无机氮的循环过程可用下图表示。
(1)海洋中的氮循环起始于氮的固定,其中属于固氮作用的一步是 (填图中数字序号)。
(2)有氧时,在硝化细菌作用下,NH4+可实现过程④的转化,将过程④的离子方程式补充完整:________NH4+ + 5O2 == 2NO2- + ________H+ +__________+__________
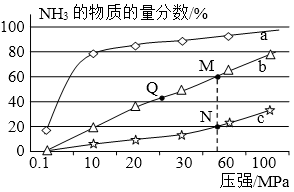
9.Ⅱ.工业合成氨原理是:N2(g)+3H2(g)
(1)曲线a对应的温度是 。
(2)关于工业合成氨的反应,下列叙述正确的是 。A.及时分离出NH3可以提高H2的平衡转化率B.上图中M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N)C.M点比N点的反应速率快D.如果N点时c(NH3)=0.2mol·L-1,N点的化学平衡常数K≈0.93L2/mol2
10.Ⅲ.尿素[CO(NH2)2]是一种非常重要的高效氮肥,工业上以NH3、CO2为原料生产尿素,该反应实际为两步反应:
第一步:2NH3(g)+CO2(g)===H2NCOONH4(s) ΔH=-272kJ·mol-1
第二步:H2NCOONH4(s)===CO(NH2)2(s)+H2O(g) ΔH=+138kJ·mol-1
(1)写出工业上以NH3、CO2为原料合成尿素的热化学方程式:_________________________
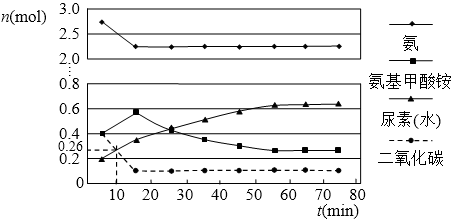
(2)某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分的物质的量随时间的变化如下图所示:
已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第_________步反应决定,总反应进行到_________min时到达平衡。
(3)电解尿素[CO(NH2)2]的碱性溶液制纯净氢气的过程中同时产生氮气。电解时,阳极的电极反应式为______________________。
正确答案
(1)②
(2) 4NH4+ + 5O2 = 2NO2- + 6H+ + N2O + 5H2O
解析
⑴读图可知第②步属于固氮作用。
⑵结合循环图可知产物包括N2O,另外有H2O生成,配平可得 4NH4+ + 5O2 = 2NO2- + 6H+ + N2O + 5H2O
考查方向
解题思路
根据工业原理判断反应发生
易错点
离子方程式的书写
正确答案
(1)200℃
(2)ABD
解析
⑴因为∆H<0,所以在相同压强下,温度升高,不利于反应正向进行,NH3的物质的量分数会减小,所以曲线a对应的温度是200℃。
⑵及时分离出NH3可以促使反应正向进行,A正确;温度相同时,平衡常数也相同,分析可知曲线b, c对应的温度分别为400℃,600℃,温度的升高促使反应逆向进行,使平衡常数K减小,B正确;相同压强下,温度越高,反应速率越快,C错误;N点时c(NH3)=0.2mol·L-1,NH3的物质的量分数为20%,又反应器中按n(N2):n(H2)=1:3投料,可求得平衡时N2与H2的物质的量浓度分别为0.2mol·L-1与0.6mol·L-1,求得N点的化学平衡常数K≈0.93L2/mol2,D正确。
考查方向
解题思路
根据工业原理判断反应发生
易错点
离子方程式的书写
正确答案
(1) 2NH3(g)+CO2(g)
(2) 2 55
(3) CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O
解析
⑴由一二步反应可得2NH3(g)+CO2(g)
⑵合成尿素总反应的快慢由第二步反应决定;反应进行到55分钟时,各物质的物质的量不再变化,反应达到平衡。
⑶ CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O
考查方向
解题思路
根据工业原理判断反应发生
易错点
离子方程式的书写
工业制硫酸时,利用接触氧化反应将SO 2转化为SO 3是一个关键步骤 。
18.某温度下,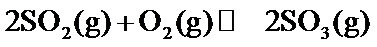
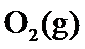
19.若体积不变的条件下,下列措施中有利于提高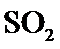
20.在硫酸工业生产过程中,有反应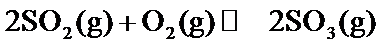
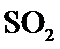
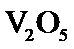
21.能判断该反应达到平衡状态的依据是___________。
22.在
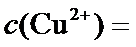
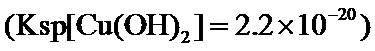
23.若在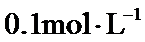
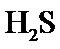
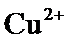
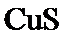
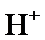

正确答案
0.56 ,减小
解析
根据反应2SO2(g)+O 2(g)⇌2SO3(g)△H=−197kJ/mol,当放出394kJ的热量时,生成SO3的物质的量为394/197×2mol=4mol,所以平衡时SO2的浓度为 (8.0mol−4mol)/10L=0.4mol/L,SO3的浓度为0.4mol/L,O2的浓度为 (20mol−2mol)/10L=1.8mol/L,所以K=0.42/(0.42×1.8)=0.56,该反应为放热反应,所以升高温度平衡向逆反应方程移动,平衡常数减小,故答为:0.56;减小。
考查方向
解题思路
根据热化学方程式及放出的热量可计算出平衡时各物质的物质的量,进而求得平衡浓度,根据平衡常数等于生成物浓度系数次幂之积除以反应物浓度系数次幂之积求得平衡常数,根据温度对平衡的影响判断K的变化;
易错点
缺乏对平衡状态的判断.化学平衡的影响因素及平衡常数的有关计算等知识点,难度中等,答题时注意分析表中数据,总结规律.
正确答案
解析
A.可逆反应中增加一种反应物的浓度可以提高另一种反应物的转化率,所以通入氧气,二氧化硫的转化率提高,故A正确;
B.减小一种反应物的浓度可以降低另一种反应物的转化率,所以移出氧气,二氧化硫的转化下降高,故B错误;
C.该反应为体积减小的反应,增大压强,平衡向体积减小的方向移动,二氧化硫的转化率提高,故C正确;
D.减小压强,平衡向体积增大的方向移动,二氧化硫的转化率减小,故D错误;
E.加入催化剂,对平衡没有影响;
故选AC;
考查方向
解题思路
A.可逆反应中增加一种反应物的浓度可以提高另一种反应物的转化率;
B.减小一种反应物的浓度可以降低另一种反应物的转化率;
C.增大压强,平衡向体积减小的方向移动;
D.减小压强,平衡向体积增大的方向移动;
E.加入催化剂,对平衡没有影响;
易错点
缺乏对平衡状态的判断.化学平衡的影响因素及平衡常数的有关计算等知识点,难度中等,答题时注意分析表中数据,总结规律.
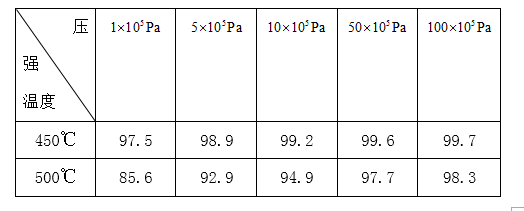
正确答案
450℃ 1×105Pa
解析
根据表中数据,在温度一定时,压强越大,二氧化硫的转化率越高,但增加的幅度不大,在压强一定时,温度越高转化率越小,考滤生成成本等因素,所以选择的条件是450℃,1×105Pa,故答案为:450℃;1×105Pa;
考查方向
解题思路
根据表中数据,在温度一定时,压强对转化率的影响,在压强一定时,温度对转化率的影响,据此选择合适的条件;
易错点
:缺乏对平衡状态的判断.化学平衡的影响因素及平衡常数的有关计算等知识点,难度中等,答题时注意分析表中数据,总结规律.
正确答案
解析
A.该反应为体积减小的反应,所以容器的压强不变,反应达到平衡状态,故A正确;
B.该反应前后气体质量守恒,体积不变,所以混合气体的密度不变,不能判断反应是否处于平衡状态,故B错误;
C.混合气体中SO3的浓度不变,则反应处于平衡状态,故C正确;
D.C(SO2)=C(SO3),不能说明正逆反应速率是否相等,故D错误;
E.v 正(SO2)=v 正(SO3),都是指正反应速率,不能确定与逆反应的关系,故E错误;
F.v 正(SO3)=2v 逆(O2),说明正逆反应速率相等,所以反应处于平衡状态,故F正确,故选:ACF.
考查方向
解题思路
根据正逆反应速率相等.各组份的组成不变以及某些外部特征可判断反应是否处于平衡状态.
易错点
缺乏对平衡状态的判断.化学平衡的影响因素及平衡常数的有关计算等知识点,难度中等,答题时注意分析表中数据,总结规律.
正确答案
2.2×10-8 0.2
解析
根据题给Cu(OH)2的溶度积即可确定pH=8时,c(OH−)=10−6mol/L,Ksp[Cu(OH)2]=2.2×10−20,则c(Cu2+)=2.2×10-8mol•L−1,在0.1mol•L−1硫酸铜溶液中通入过量H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的溶质为硫酸,c(SO42−)不变,为0.1mol•L−1,由电荷守恒可知c(H+)为0.2mol•L−1,故答案为:2.2×10-8;0.2.
考查方向
解题思路
溶液的pH=8即c(OH−)=1×10−6 mol•L−1,根据Ksp[Cu(OH)2]=c(Cu2+)•c2(OH−)计算c(Cu2+);根据溶液的电中性计算H+浓度。
正确答案
2.2×10-8 0.2
解析
根据题给Cu(OH)2的溶度积即可确定pH=8时,c(OH−)=10−6mol/L,Ksp[Cu(OH)2]=2.2×10−20,则c(Cu2+)=2.2×10-8mol•L−1,在0.1mol•L−1硫酸铜溶液中通入过量H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的溶质为硫酸,c(SO42−)不变,为0.1mol•L−1,由电荷守恒可知c(H+)为0.2mol•L−1,
故答案为:2.2×10-8;0.2.
考查方向
解题思路
溶液的pH=8即c(OH−)=1×10−6 mol•L−1,根据Ksp[Cu(OH)2]=c(Cu2+)•c2(OH−)计算c(Cu2+);根据溶液的电中性计算H+浓度.
易错点
缺乏对平衡状态的判断.不会运用盖斯定律的应用.溶度积常数的有关计算以及物质的量浓度的有关计算等。
5. 下列物质分类正确的是
正确答案
解析
A.SO2、SiO2均能和碱反应生成盐和水,为酸性氧化物,CO不与酸或水反应,属于不成盐氧化物,故A错误;
B.油脂是由高级脂肪酸和甘油形成的酯,多肽是由氨基酸形成的,淀粉属于多糖,故B错误;
C.四氯化碳在水溶液中和熔融状态下都不能导电,属于非电解质,故C错误;
D.福尔马林是甲醛水溶液,属于混合物;漂粉精主要成分是次氯酸钙,属于混合物;氨水氨气溶于水形成的溶液,属于混合物,故D正确;
考查方向
物质的分类
解题思路
A.酸性氧化物能与水作用成酸或与碱作用成盐和水的氧化物;
B.依据酯是由醇和酸经过酯化反应生成的有机物;
C.电解质是在水溶液中或熔融状态下能导电的化合物;
D.由不同物质组成的物质为混合物
易错点
福尔马林是甲醛水溶液,属于混合物
教师点评
本题考查了物质的分类,掌握分类的依据和物质的性质是解题的关键,题目较简单。
知识点
7.下列操作不正确的是
正确答案
解析
A.氯化铁是强酸弱碱盐,铁离子易水解,为防止水解,在配制氯化铁溶液时需要加入少量稀盐酸,故A正确;
B.钠易和空气中水、氧气反应而变质,其密度大于没有且不和煤油反应,所以金属钠保存在装有煤油的带玻璃塞的广口瓶中,故B正确;
C.溴易腐蚀橡皮塞,应该用玻璃塞的试剂瓶,故C错误;
D.银能溶于稀硝酸生成硝酸银,所以可以用稀硝酸洗去附在试管内壁的银镜,故D正确;
考查方向
化学基本实验评价
解题思路
A.氯化铁是强酸弱碱盐,铁离子易水解;
B.钠易和空气中水、氧气反应而变质,其密度大于没有且不和煤油反应;
C.溴易腐蚀橡皮塞;
D.银能溶于稀硝酸
易错点
A项中加入盐酸来抑制氯化铁的水解
教师点评
本题考查化学实验方案评价,涉及盐类水解、药品贮存、物质性质等知识点,明确实验原理及物质性质是解本题关键,熟练掌握常见元素化合物性质,题目难度不大。
知识点
3.炼铁、炼钢过程中,先被氧化后被还原的元素是( )
正确答案
解析
炼钢过程中反应原理:Fe+O2 


考查方向
氧化还原反应
解题思路
炼钢过程中反应原理:Fe+O2


易错点
炼钢过程中的化学反应
教师点评
本题考查了氧化还原反应,把握化工生产中高炉炼铁所涉及的化学反应是解题的关键,题目难度不大,侧重于基础知识的考查
知识点
10.在测定硫酸铜晶体结晶水含量的实验中,会导致测定结果偏低的是( )
正确答案
解析
A.加热时间过长,部分变黑等都将导致硫酸铜分解固体变黑说明硫酸铜分解生成CuO与SO3,造成加热前后固体的质量差偏大,使测量结果偏高,故A错误;
B.坩锅内附有不分解的杂质,而加热前后固体的质量差不变,测量结果不变,故B错误;
C.加热过程中有少量晶体溅出,造成加热前后固体的质量差偏大,使测量结果偏高,故C错误;
D.晶体不纯,含有不挥发杂质,造成加热前后固体的质量差偏小,使测量结果偏低,故D正确;
考查方向
定量测定与误差分析
解题思路
在硫酸铜晶体结晶水含量测定中,加热前后质量的减少量即是失去结晶水的质量,质量差偏大,使n值偏大,若质量差偏小,使n值偏小,据此进行解答
易错点
B、D两项的区别
教师点评
本题考查硫酸铜晶体中结晶水的测定,题目难度不大,明确测定方法为解答关键,注意分析误差时从导致加热前后的质量差进行判断,试题培养了学生的化学实验能力
知识点
14.下列实验不能达到目的的是
正确答案
解析
A.SO2与HClO反应生成H2SO4,是HClO的强氧化性所致,不是酸性所致,所以不能得出H2SO4的酸性比HClO强的结论,故A错误;
B.无色酚酞遇碱变红色,向Na2SiO3溶液中滴加酚酞,溶液变红,说明该溶液呈碱性,则硅酸钠水解导致溶液呈碱性,故B正确;
C.铝与氧气反应生成氧化铝的熔点高,则铝箔在酒精灯火焰上加热熔化但不滴落,故C正确;
D.氯气和水反应生成盐酸和次氯酸,溶液呈酸性,则氯水中加入蓝色石蕊试纸变红色,次氯酸有漂白性,所以试纸最后褪色,故D正确
考查方向
实验方案评价
解题思路
A.发生氧化还原反应生成硫酸,不能比较酸性的强弱;
B.弱酸盐因水解显碱性;
C.铝与氧气反应生成氧化铝的熔点高;
D.氯气和水反应生成盐酸和次氯酸,溶液呈酸性,次氯酸有漂白性
易错点
A项,次氯酸虽然是弱酸但具有强氧化性
教师点评
本题考查化学实验方案评价,涉及氧化还原反应、次氯酸的漂白性、盐类水解等知识点,题目难度不大
知识点
4.下列气体在常温常压下不能共存的是
正确答案
解析
A.常温下反应生成氯化铵,不能大量共存,故A选;
B.常温下不反应,光照的条件反应,可大量共存,故B不选;
C.常温下不反应,反应需要点燃、加热等,可大量共存,故C不选;
D.常温下不反应生成,要在催化剂和加热的条件反应,故D不选;
考查方向
元素及其化合物
解题思路
常温下,能反应的气体不能大量共存,以此来解答
易错点
反应的条件
教师点评
本题考物质的化学性质,为高频考点,把握常见物质的性质及反应的条件为解答的关键,题目难度不大
知识点
臭氧是一种强氧化剂可与碘化钾水溶液发生反应生成氧气和单质碘。向反应后的溶液中滴入酚酞,溶液变为红色。
28.试写出该反应的化学方程式(Ⅰ): 。
29.该反应体系中还伴随着化学反应(Ⅱ):I2(aq) + I-(aq) 
反应Ⅱ的平衡常数表达式为: 。
30.根据下图,计算反应Ⅱ中3-18s内用I2表示的反应速率为 。
为探究Fe2+ 对上述O3氧化I-反应的影响,将O3通入含Fe2+和 I
31.试预测因Fe2+的存在可能引发的化学反应(请用文字描述,如:“碘离子被臭氧氧化为碘
单质”)[来(1) (2) ;该反应的过程能显著降低溶液的pH,并提高反应(Ⅰ)中Ⅰ-的转化率,原因是:
。
32.利用I2的氧化性可测定钢铁中硫的含量。做法是将钢铁中的硫转化为H2SO3,然后以淀粉为指示剂,用一定浓度的I2溶液进行滴定。综合上述各步反应及已
正确答案
O3+2KI+H2O→O2+I2+2KOH
解析
根据题意,臭氧是氧化剂,碘化钾是还原剂,I-被氧化成单质碘,酚酞变红,说明有碱生成。所以可得:O3+2KI→O2+I2+2KOH,再依据H的守恒知道反应物应当还有水,所以:O3+2KI+H2O=O2+I2+2KOH
考查方向
陌生情境下化学方程式的书写
解题思路
根据题意,臭氧是氧化剂,碘化钾是还原剂,I-被氧化成单质碘,酚酞变红,说明有碱生成。所以可得:O3+2KI→O2+I2+2KOH,再依据H的守恒知道反应物应当还有水,所以:O3+2KI+H2O=O2+I2+2KOH
易错点
配平容易出错。
教师点评
典型的方程式书写题,要多练。
正确答案
解析
根据化学方程式写出平衡常数表达式:
考查方向
平衡常数表达式的书写。
解题思路
根据化学方程式写出平衡常数表达式:
易错点
想当然以为单质碘是固体,不计入表达式。
教师点评
简单题。
正确答案
解析
从图中很容易读数:V(I-)△c/△t=
考查方向
化学反应速率的计算
解题思路
从图中很容易读数:V(I-)△c/△t=
易错点
速率表达式要准确。
教师点评
速率表达式要准确。
正确答案
(1)(1分)亚铁离子被臭氧氧化为铁离子(2)(2分)铁离子水解生成氢氧化铁沉淀 ;Fe3+形成Fe(OH)3过程中消耗OH-,使反应I平衡朝正反应方向移动,促进I-转化
解析
亚铁离子具有强还原性,臭氧是强氧化剂,所以是(1)(亚铁离子被臭氧氧化为铁离子。
溶液PH值降低,酸性增强,显然是因为铁离子的水解。所以(2)铁离子水解生成氢氧化铁沉淀 ;
而且,可以得出:2H++2Fe2++O3=2Fe3++O2+H2O,酸性
增强有利于反应朝着正反应方向进行,所以Fe3+形成Fe(OH)3过程中消耗OH-,使反应I平衡朝正反应方向移动,促进I-转化
考查方向
氧化还原反应的分析。
解题思路
亚铁离子具有强还原性,臭氧是强氧化剂,所以是(1)(亚铁离子被臭氧氧化为铁离子。
溶液PH值降低,酸性增强,显然是因为铁离子的水解。所以(2)铁离子水解生成氢氧化铁沉淀 ;
而且,可以得出:2H++2Fe2++O3=2Fe3++O2+H2O,酸性
增强有利于反应朝着正反应方向进行,所以Fe3+形成Fe(OH)3过程中消耗OH-,使反应I平衡朝正反应方向移动,促进I-转化
易错点
综合了氧化还原反应和盐类水解反应,而亚铁离子的氧化是需要氢离子的。
教师点评
综合性比较强。
正确答案
解析
根据化学常识可知Fe3+> I2,再根据氧化性强的氧化剂得到氧化性弱的氧化产物,H2SO3被I2氧化成SO

考查方向
氧化性强弱比较。
解题思路
根据化学常识可知Fe3+> I2,再根据氧化性强的氧化剂得到氧化性弱的氧化产物,H2SO3被I2氧化成SO

易错点
氧化性强弱比较原则:氧化剂》氧化产物
教师点评
此题对氧化还原反应的考察是个典型的好题。
扫码查看完整答案与解析