- 海水资源及其综合利用
- 共118题
2. 分类是化学学习中经常用到的方法,下列对一些物质或化学反应的分类以及依据正确的是 ( )
正确答案
解析
A.酸的定义是指电离出的阳离子都是H+,而不是含有氢元素,故错误;
B.豆浆是胶体,且分散质粒子直径在1nm~100 nm之间,故正确;
C.Na和H2O的反应是离子反应,有H+离子参加,故错误;
D.氯气中也能燃烧,且燃烧是指所有的发光发热的剧烈的氧化还原反应,故错误。
考查方向
解题思路
依据性质与概念等逐项判断。
易错点
易错选A或C。
知识点
5.下列叙述正确的是( )。
正确答案
解析
氯化铵是强酸弱碱盐,其水溶液显酸性,溶液呈中性一定是氨水稍过量,A错误。醋酸溶液中不断加水稀释,醋酸的电离程度增大,但是c(H+)在减小,PH在增大,B错误。因为是饱和石灰水,加入少量CaO后,c(OH-)没有改变,故PH也不变,C正确。胶体是电中性,D错误。
考查方向
解题思路
弱碱与强酸形成的盐,不能忽略其水解。
易错点
弱电解质的电离度与PH值之间的关系
知识点
2.下列事实不能用元素周期律解释的是
正确答案
解析
A.非金属性Br>I,氢化物稳定性:HBr>HI,能用元素周期律解释,故A正确;
B.金属性Na>Li,0.1 mol•L-1溶液的pH:NaOH>LiOH,能用元素周期律解释,故B正确;
C.向Na2SO3溶液中加盐酸,发生强酸制取弱酸的反应,不能用元素周期律解释,故C错误;
D.金属性Mg>Al,Mg与酸反应剧烈,能用元素周期律解释,故D正确;
考查方向
解题思路
A.非金属性越强,氢化物越稳定;
B.金属性越强,最高价氧化物水化物碱性越强;
C.向Na2SO3溶液中加盐酸,发生强酸制取弱酸的反应;
D.金属性越强,与酸反应越剧烈
易错点
物质的性质及元素周期律
知识点
6.液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点。某科研人员设计了以液态肼(N2H4)为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池(如图所示)。该固体氧化物电解质的工作温度高达700~900℃时,O2-可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质。下列说法正确的是
正确答案
解析
电极甲通入的是N2H4在电池工作中发生氧化还原,是电池的负极,A错误。题目中讲明反应中生生物均为无毒无害的物质,不会产生有毒的NO,B错误。因为本电池是以固体氧化物为电解质的新型燃料电池,O2-可在该固体氧化物电解质中自由移动,正极反应为O2+4e-
考查方向
解题思路
由电池二极通入物质确定正负极,结合选项逐一分析。
易错点
原电池工作原理、电极反应书写
知识点
5.常温下,下列各组离子一定能在指定溶液中大量共存的是()
正确答案
解析
A.MnO4-在溶液中为紫色,错误B.Fe3+ 和I-发生氧化还原反应,不能共存, 错误;C.滴入甲基橙变红色的溶液说明溶液呈酸性,可以共存,正确;D.c(H+)=1×10-12 mol·L-1的溶液的PH为12,溶液为碱性,不能与Cu2+共存,生成弱电解质,错误。
考查方向
解题思路
注意审题,离子共存问题条件很重要
易错点
审题不清
知识点
6.下列有关实验原理或实验操作正确的是()
正确答案
解析
A.高锰酸钾酸性溶液具有强氧化性,体现二氧化硫的还原性,错误;B.浓盐酸具有挥发性,与碳酸氢钠溶液反应放出气体也可能是浓盐酸挥发出来的氯化氢气体,错误;C.澄清的石灰水和碳酸钠溶液, Ca2++CO32-=CaCO3,澄清的石灰水和碳酸氢钠溶液,会中和HCO3-中的H,中和后产生了CO32-,与溶液中的Ca2+结合,也会产生沉淀:(根据碳酸氢钠用量不同,方程式有两种写法) 碳酸氢钠少量时,Ca2++OH-+HCO3-=CaCO3沉淀+H2O, 或碳酸氢钠足量时,Ca2++2OH-+2 HCO3-=CaCO3沉淀+CO32-+2H2O,因都会产生沉淀,所以无法鉴别,错误;D.因苯酚难溶于水,且酸性比碳酸弱,可在混合物中加入NaOH溶液,充分振荡,待完全反应后,用分液漏斗分离,正确。
考查方向
解题思路
注意实验装置的细节,再结合相关实验原理进行解题
易错点
实验装置的原理易混淆
知识点
7.反应2NO(g)+2H2(g)




T℃时测得有关实验数据如下:
下列说法错误的是()
正确答案
解析
A.①2NO+H2═N2+H2O2(慢),②H2O2+H2═2H2O(快),反应历程中反应慢的决定反应速率,整个反应速度由第①步反应决定,故A正确;
B.反应①难以进行,说明反应的活化能高,正反应的活化能一定是①>②,故B错误;
C.比较图表数据ⅠⅡ数据NO浓度不变,氢气浓度增大一倍,反应速率增大一倍,ⅢⅣ数据分析,H2浓度不变,NO浓度增大一倍,反应速率增大到4倍,据此得到速率方程,v=Kc2(NO)•c(H2),依据Ⅰ中数据计算K=5000,则速率方程v=5000c2(NO)•c(H2),故C正确;
D.反应2NO(g)+2H2(g)═N2(g)+2H2O(g)中,每生成7gN2放出166kJ的热量,生成28gN2放热664KJ,热化学方程式为:2NO(g)+2H2(g)═N2(g)+2H2O(g)△H=-664kJ•mol-1,故D正确。
本题正确答案是B
考查方向
本题考查了化学反应能量变化分析,热化学方程式书写,主要是催化剂作用,化学反应速率方程的推导和计算应用,题目难度中等。
解题思路
A.依据反应过程中的两步反应可知,反应慢的决定整个反应速率;
B.反应①难以进行,说明反应的活化能高;
C.比较图表数据ⅠⅡ数据NO浓度不变,氢气浓度增大一倍,反应速率增大一倍,ⅢⅣ数据分析,H2浓度不变,NO浓度增大一倍,反应速率增大到4倍,据此得到速率方程,代入数值计算得到K分析判断方程正误;
D.反应2NO(g)+2H2(g)═N2(g)+2H2O(g)中,每生成7gN2放出166kJ的热量,生成28gN2放热664KJ,结合热化学方程式书写分析判断,标注物质聚集状态和对应反应的焓变。
知识点
Ⅰ.在一定条件下,xA+yB 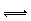
Ⅱ.已知NO2和N2O4可以相互转化:2NO2(g) 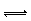
12.已知C是气体,且x+y=z,加压时平衡如果发生移动,则平衡必向 移动。
13.若B、C是气体,其他条件不变时增加A的用量,
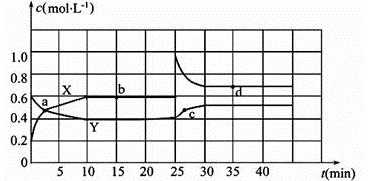
14.图中共有两条曲线X和Y,其中曲线 表示NO2浓度随时间的变化;a、b、c、d四个点中,表示化学反应处于平衡状态的点是 。
15.①前10 min内用NO2表示的化学反应速率v(NO2)= mol·L-1·min-1
②0~15 min ,反应2NO2(g) 
③25 min~35 min时,反应2NO2(g) 
16.反应25 min时,若只改变了某一个条件,使曲线发生如上图所示的变化,该条件可能是 (用文字表达),若要达到使NO2(g)的百分含量与d点相同的化学平衡状态,在25 min时还可以采取的措施是 。
A.加入催化剂
B.缩小容器体积
C.升高温度
D.加入一定量的N2O4
正确答案
(1)逆反应方向(左) 。
解析
(1)根据可逆反应方程式,已知C是气体,且x+y=z,加压时平衡如果发生移动,则说明该反应不是气体分子数相等的反应,尽管有x+y=z,但是必定A或B有一个不是气体,因此该反应是气体体积增加的反应,故加压平衡必向逆反应方向移动。
考查方向
解题思路
依据化学反应速率、化学平衡及平衡常数等原理解题。
易错点
若要达到使NO2(g)的百分含量与d点相同的化学平衡状态,在25 min时还可以采取的措施是
正确答案
(2)固体或纯液体。
解析
(2)若B、C是气体,其他条件不变时增加A的用量,平衡不移动,说明A没有浓度改变,则A的状态为固体或纯液体。
考查方向
解题思路
依据化学反应速率、化学平衡及平衡常数等原理解题。
易错点
若要达到使NO2(g)的百分含量与d点相同的化学平衡状态,在25 min时还可以采取的措施
正确答案
(1)X ; b和d 。
解析
根据浓度的变化程度来判断,浓度的变化量之比等于化学方程式中的化学计量数之比,浓度变化较快的为NO2,即曲线X表示NO2浓度随时间的变化。当体系中物质的量浓度不再发生变化时,即达到平衡,所以b、d点为平衡点。
考查方向
解题思路
依据化学反应速率、化学平衡及平衡常数等原理解题。
正确答案
(2)①0.04 ;②10/9;③ = 。
解析
①前10 min内,NO2 的浓度变化量为(0.6-0.2) mol/L =0.4 mol/L,用NO2表示的化学反应速率v(NO2)=0.4 mol·L-1÷10 min =0.04 mol·L-1·min-1。
②0~15 min ,反应2NO2(g)
③反应在25 min~35 min时,N2O4 浓度逐渐增大,NO2 的浓度迅速增大后又逐渐减小,所以一定是增大NO2 的浓度,没有改变温度,故反应2NO2(g)
考查方向
解题思路
依据化学反应速率、化学平衡及平衡常数等原理解题。
正确答案
(3)增大NO2的浓度;B、D。
解析
根据图像可知25 min时X浓度突然增大,Y浓度不变,说明增大了NO2的浓度,根据方程式的特点可知,增加NO2浓度相当于增大体系压强,所以也可以采取缩小容器的体积,C项正确,增大N2O4 的浓度也相当于增大压强,平衡正向移动,D项正确;答案选B、D。
考查方向
解题思路
依据化学反应速率、化学平衡及平衡常数等原理解题。
易错点
(3)若要达到使NO2(g)的百分含量与d点相同的化学平衡状态,在25 min时还可以采取的措施是?。
发展洁净煤技术、利用CO2制备清洁能源
8.将煤转化成

9.CO2制备甲醇:CO2(g

在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2(g) 和CH3OH(g)
浓度随时间变化如图1所示
①0~9min时间内,该反应的平均反应速率ν(H2) = _________________________。
②在相同条件下,密闭容器的体积压缩至0.5 L时,此反应达平衡时放出的热量(Q)可能是________(填字母序号)kJ。
a. 0 < Q < 29.5 b. 29.5 < Q < 36.75 c. 36.75 < Q < 49 d. 49 < Q < 98
③在一定条件下,体系中CO2的平衡转化率(α)
与L和X的关系如图2所示,L和X 分别表示
温度或压强。
i. X表示的物理量是 ________________ 。
ii. 判断L1与L2的大小关系,并简述理由:
______________________________。
10.利用铜基催化剂光照条件下由CO2和H2O制备
11.利用CO2和NH3为原料也合成尿素,在合成塔中的主要反应可表示如下:
反应①:2NH3(g)+CO2(g) 
反应②:NH2CO2NH4(s) 
总反应:2NH3(g)+CO2(g) 
则反应①的△H1=_______________。
正确答案
不变
解析
:将煤转化成水煤气的反应:C(s)+H2O⇌CO2(g)+H2(g)可有效提高能源利用率,若在上述反应体系中加入催化剂(其他条件保持不变),催化剂改变反应速率不改变化学平衡,不改变反应焓变,此反应的△H不变,故答案为:不变;
考查方向
解题思路
催化剂只改变反应速率不改变化学平衡;
易错点
盖斯定律的应用,电解池电极反应式的书写、化学平衡的移动因素
正确答案
① 0.25 mol·L-1·min-1 ② c ③ i. 温度 ii. L1>L2,因为温度一定时,增大压强,CO2平衡转化率增大
解析
:①图象读取甲醇生成浓度,结合反应速率概念计算甲醇的反应速率=
,反应速率之比等于化学方程式计量数之比,V(H2)=3V(CH3OH(g)=3×
=0.25mol/L•min,故答案为:0.25mol/L•min;②CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,反应达到平衡状态消耗二氧化碳物质的量浓度=1mol/L-0.25mol/L=0.75mol/L,物质的量为0.75mol,反应放出热量=49KJ/mol×0.75mol=36.75KJ,反应焓变是指1mol二氧化碳和3mol氢气完全反应放出的热量为49KJ,反应是可逆反应,在体积为1L的密闭容器中,充入1molCO2和3molH2,反应放热一定小于49KJ,在相同条件下,密闭容器的体积缩小至0.5L时,压强增大,平衡正向进行,反应放出热量会增多,大于36.75KJ,则36.75<Q<49,故答案为:c;
③CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,反应是气体体积减小的放热反应,i.温度升高,平衡逆向进行,二氧化碳转化率减小,所以X为温度,L为压强,故答案为:温度;ii.温度一定压强增大平衡正向进行二氧化碳转化率增大,所以L1>L2,故答案为:L1>L
考查方向
解题思路
①根据图象得到甲醇生成浓度,结合反应速率概念计算甲醇的反应速率,依据反应速率之比等于化学方程式计量数之比得到氢气反应速率;
②反应焓变是指1mol二氧化碳和3mol氢气完全反应放出的热量为49KJ,反应是可逆反应,在体积为1L的密闭容器中,充入1molCO2和3molH2,反应放热一定小于49KJ,结合图象中二氧化碳转化率计算此时达到平衡放出的热量,在相同条件下,密闭容器的体积缩小至0.5L时,压强增大,平衡正向进行,反应放出热量会增多;
③反应是气体体积减小的放热反应,升温平衡逆向进行,增大压强平衡正向进行,据此分析图象确定表示的物理量
易错点
盖斯定律的应用,电解池电极反应式的书写、化学平衡的移动因素
正确答案
解析
:根据电解池工作原理,与电源负极相连是阴极,正极相连的是阳极,据图所示:阴极(a)CO2转化CH3OH,据元素守恒和电荷守恒即可写出其电极反应式:CO2 + 6e- + 6H+ ==CH2OH + H2O;阳极(b)在光照条件下H2O转化为O2;即2H2O -4e- ==O2 +4 H+ 故答案为:CO2 + 6e- + 6H+ ==CH2OH + H2O
考查方向
解题思路
根据电解池工作原理,与电源负极相连是阴极,正极相连的是阳极,据图所示:阴极(a)CO2转化CH3OH,据元素守恒和电荷守恒即可写出其电极反应式:CO2 + 6e- + 6H+ ==CH2OH + H2O;阳极(b)在光照条件下H2O转化为O2;即2H2O -4e- ==O2 +4 H+
易错点
盖斯定律的应用,电解池电极反应式的书写、化学平衡的移动因素
正确答案
-159.47KJ/mol
解析
:(1)反应Ⅰ:2NH3(g)+CO2(g)⇌NH2COONH4(s)△H1=akJ•mol-1
反应Ⅱ:NH2COONH4(s)⇌CO(NH2)2(s)+H2O(g)△H2=+72.49kJ•mol-1
总反应Ⅲ:2NH3(g)+CO2(g)⇌CO(NH2)2(s)+H2O(g)△H3=-86.98kJ•mol-1
依据盖斯定律计算反应Ⅰ+反应Ⅱ得到:2NH3(g)+CO2(g)⇌CO(NH2)2(s)+H2O(g)△H3=△H1+72.49kJ•mol-1=-86.98kJ•mol-1;△H1=-159.47kJ•mol-1,故答案为: -159.47kJ•mol-1
考查方向
解题思路
根据盖斯定律反应Ⅰ的热化学方程式可以依据反应Ⅱ、Ⅲ热化学方程式计算得到,同时得到反应的焓变。
易错点
盖斯定律的应用,电解池电极反应式的书写、化学平衡的移动因素
4.下列实验操作可以达到目的的是
正确答案
解析
A.氯气能与碱石灰反应,不能用碱石灰干燥,故A错误;
B.酸性条件下,溴离子和银离子发生离子反应,所以在做溴离子的检验中要首先中和碱,故B错误;
C.Na2CO3+2HCl=2NaCl+H2O+CO2↑,根据反应前后的质量差为m1g-m2 g可计算碳酸钠的质量,然后计算质量分数,故C正确;
D.水的体积不等于溶液的体积,应加水至溶液的体积等于100mL,故D错误.
考查方向
解题思路
A.氯气能与碱石灰反应;
B.检验溴离子应在酸性条件下;
C.根据质量差可计算质量分数;
D.水的体积不等于溶液的体积.
易错点
气体的干燥和溶液的配制、物质的检验
知识点
扫码查看完整答案与解析