- 物质的组成、性质和分类
- 共146题
A、B、C、D、E、F均为周期表中前四周期的元素。请按要求回答下列问题。
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
下列有关A、B的叙述不正确的是______________。
a,离子半径A<B
b,电负性A<B
c,单质的熔点A>B
d,A、B的单质均能与某些氧化物发生置换反应
e,A的氧化物具有两性
f,A、B均能与氯元素构成离子晶体
(2)C是地壳中含量最高的元素,C基态原子的电子排布式为_______。
(3)E元素原子的最外层电子数是其次外层电子数的2倍,则乙醇分子中E原子的杂化方式是__________。E的一种单质具有空间网状结构,晶胞结构如右图2。已知位于晶胞内部的4个原子,均位于体对角线的

(4)F与硒元素同周期,F位于p区中未成对电子最多的元素族中,F原子的价电子排布
图为_________;
“>”或“<”“=”
正确答案
答案:
(1)bf (2)1s22s22p4 12 (3) sp3
(4)
解析
略
知识点
已知X,Y,Z,Q为短周期非金属元素,R是长周期元素,X原子的电子占据2个电子层且原子中成对电子数是未成对电子数的2倍;Y的基态原子有7种不同运动状态的电子;Z元素在地壳中含量最多;Q是电负性最大的元素;R+离子只有三个电子层且完全充满电子。回答下列问题:(答题时,X、Y、Z、Q、R用所对应的元素符号表示)
(1)X元素为____,X、Y、Z中第一电离能最大的是____
(2)已知Y2Q2分子存在如图所示的两种结构(球棍模型,短线不一定代表单键):
该分子中Y原子的杂化方式是____
(3)X与Y元素可以形成一种超硬新材料,其晶体部分结构如图所示,有关该晶体的说法正确的是_____(填正确答案编号)。
A.该晶体属于分子晶体
B.此晶体的硬度比金刚石还大
C.晶体的化学式是X3Y4
D.晶体熔化时破坏共价键
(4)有一种AB型分子与Y单质分子互为等电子体,它是一种常用的还原剂,其化学式
为______
(5)R的基态原子的电子排布式为_____,R与Z形成的某离子晶体的晶胞结构如图,则该晶体的化学式为____,该晶体的密度为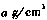
正确答案
解析
略
知识点
我国科学家通过测量SiO2中26Al和10Be两种元素的比例来确定“北京人”年龄,这种测量方法叫铝铍测年法。关于26Al和10Be的说法不正确的是
正确答案
解析
略
知识点
高纯晶体硅是信息技术的关键材料。
(1)硅元素位于周期表的______周期______族,在周期表的以下区域中,可以找到类似硅的半导体材料的是________(填字母序号)。
a. 过渡元素区域
b. 金属和非金属元素的分界线附近
c. 含有氟、氯、硫、磷等元素的区域
(2)工业上用石英砂和焦炭可制得粗硅。
已知:
请将以下反应的热化学方程式补充完整:
SiO2(s) + 2C(s) === Si(s) + 2CO(g) △H = ________
(3)粗硅经系列反应可生成硅烷(SiH4),硅烷分解生成高纯硅。已知硅烷的分解温度远低于甲烷,用原子结构解释其原因:_________,Si元素的非金属性弱于C元素,硅烷的热稳定性弱于甲烷。
(4)将粗硅转化成三氯氢硅(SiHCl3),进一步反应也可制得高纯硅。
①SiHCl3中含有的SiCl4、AsCl3等杂质对晶体硅的质量有影响。根据下表数据,可用________ 方法提纯SiHCl3。
②用SiHCl3制备高纯硅的反应为
a. 该反应的平衡常数随温度升高而增大
b. 横坐标表示的投料比应该是
c. 实际生产中为提高SiHCl3的利用率,应适当升高温度
正确答案
见解析。
解析
(1)三 ⅣA b
(2)+638.4 kJ·mol-1
(3)C和Si最外层电子数相同(或“是同主族元素”),C原子半径小于Si(或“C原子电子层数少于Si”)
(4)①蒸馏(或分馏)
②a、c
知识点
已知X,Y,Z,Q为短周期非金属元素,R是长周期元素,X原子的电子占据2个电子层且原子中成对电子数是未成对电子数的2倍;Y的基态原子有7种不同运动状态的电子;Z元素在地壳中含量最多;Q是电负性最大的元素;R+离子只有三个电子层且完全充满电子。
回答下列问题:(答题时,X、Y、Z、Q、R用所对应的元素符号表示)
(1)X元素为____,X、Y、Z中第一电离能最大的是____
(2)已知Y2Q2分子存在如图所示的两种结构(球棍模型,短线不一定代表单键):
该分子中Y原子的杂化方式是____
(3)X与Y元素可以形成一种超硬新材料,其晶体部分结构如图所示,有关该晶体的说法正确的是_____(填正确答案编号)。
A,该晶体属于分子晶体
B,此晶体的硬度比金刚石还大
C,晶体的化学式是X3Y4
D,晶体熔化时破坏共价键
(4)有一种AB型分子与Y单质分子互为等电子体,它是一种常用的还原剂,其化学式
为______
(5)R的基态原子的电子排布式为_____,R与Z形成的某离子晶体的晶胞结构如图,则该晶体的化学式为____,该晶体的密度为
正确答案
(1)
(2)
(3)
(4)
(5)
解析
略
知识点
化合物甲由不同周期的短周期元素X、Y组成,是良好的耐热冲击材料。
X原子的最外层电子数比次外层电子数少5, Y元素是空气中含量最高的元素。
(1)X的原子结构示意图是 ,甲的化学式是
(2)X的硫酸盐溶液与过量
(3) 1mol X单质与Fe2O3反应,放出414.21 KJ热量,该反应的热化学反应方程式是 。
(4)利用以X为阳极,在H2SO4 溶液中电解的方法,可在X表面形成X的氧化物,此方法可用于工业制备氧化膜,写出阳极电极反应式 。
(5)一定条件下,甲和水缓慢作用生成含Y的化合物乙,乙分子含有10个电子。乙在微生物作用下可与O2发生反应,当有1 mol 乙参加反应时,电子转移6 mol,该反应的化学方程式是 。
正确答案
见解析。
解析
(1)
(2)Al3++4OH-===AlO2-+2H2O
(3)2Al(s) + Fe2O3(s) === Al2O3(s) +2Fe(s) △H = -828.42 kJ/mol
(4)2Al+3H2O-6e-= Al2O3+ 6H+
(5)
知识点
科学家根据自然界存在的N2制取N3,其后又陆续制取出N5、含N5+的化合物及N60。N5+极不稳定,需保存在-80℃的干冰中;N5+由于其极强的爆炸性,又称为“盐粒炸弹”;N60与C60结构相似,并在受热或机械撞击后,其中积蓄的巨大能量会在瞬间释放出。分析上述材料,下列说法中不正确的是
正确答案
解析
略
知识点
我国的四大发明之一黑火药,爆炸时发生反应的化学方程式为:
S+2KNO3 +3C→K2S +3CO2↑+N2↑。请根据其中所含的元素回答下列问题:
(1)如图所示为元素周期表中钾元素框图,数据“39.10”表示的是_________;钾元素在周期表中的位置为_________。
(2)上述元素中,简单离子电子层结构与氩原子相同,且离子半径最大的元素,其原子核外有_________种不同能级的电子;已知其氧化物中一种对应水化物能与氯单质反应,该反应的化学方程式是 ___________________________。
(3)上述反应生成物中,属于非电解质的是________(写结构式);其中熔点最高的物质的电子式是_________。
(4)上述化学方程式的元素中,属于同周期元素的非金属性由强到弱的顺序为_________,能证明其递变规律的事实是( )(填字母)
A.最高价氧化物对应水化物的酸性 B.气态氢化物的沸点
C.单质与氢气反应的难易程度 D.其两两组合形成的化合物中元素的化合价
(5)上述反应中,如1.5mol还原剂_________(填“得到”或“失去”)_________mol电子,则生成_________g还原产物。
正确答案
(1)K元素的相对原子质量;第四周期IA族
(2)5,H2SO3+Cl2+H2O→H2SO4+2HCl
(3)O=C=O
(4)O>N>C,D
(5) 失去,6,69克
解析
略
知识点
主族元素M、R形成的简单离子M2-离子与R+离子的核外电子数之和为20,下列说法正确的是
正确答案
解析
略。
知识点
形成物质世界多样性的原因有
①元素种类;②同位素;③化学键成键方式;④同分异构现象;⑤同素异形现象
正确答案
解析
略
知识点
扫码查看完整答案与解析