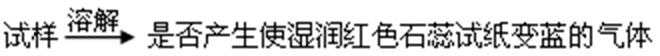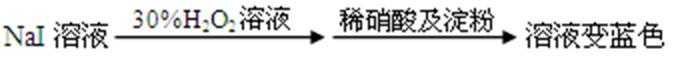- 蒸发和结晶、重结晶
- 共19题
4,7-二甲基香豆素(熔点:132.6℃)是一种重要的香料,广泛分布于植物界中,由间甲苯酚为原料的合成反应如下:
实验装置图如下:
主要实验步骤:
步骤1.向装置a中加入60mL浓硫酸,并冷却至0℃以下,搅拌下滴入间甲苯酚30mL(0.29mol)和乙酰乙酸乙酯26.4mL (0.21mol)的混合物。
步骤2.保持在10℃下,搅拌12h,反应完全后,将其倒入冰水混合物中,然后抽滤、水洗得粗产品
步骤3.粗产品用乙醇溶解并重结晶,得白色针状晶体并烘干,称得产品质量为33.0g。
(1)图中仪品名称:a ,c 。
(2)简述装置b中将活塞上下部分连通的目的 。
(3)浓H2SO4需要冷却至0℃以下的原因是 。
(4)反应需要搅拌12h,其原因是 。
(5)确定最终产品是4,7-二甲基香豆素的实
(6)本次实验产率为 。
正确答案
(1)三颈烧瓶;布氏漏斗
(2)平衡上下气压,使漏斗中液体顺利流下。
(3)防止浓硫酸将有机物氧化和炭化。
(4)使反应物充分接触反应,提高反应产率
(5)测量熔点或测定其红外(紫外)光谱(及核磁共振氢谱)等。
(6)90.3%。
解析
略
知识点
乙酰水杨酸俗称阿司匹林(
制备基本操作流程如下:
主要试剂和产品的物理常数如下表:
回答下列问题:
(1)合成阿司匹林时,最合适的加热方法是 。
(2)合成阿司匹林时,必须使用干燥的仪器,其原因是 。
(3)减压过滤所得粗产品要用少量冰水洗涤,其目的是 。

①沸石的作用是 ;
②冷凝水的流进方向是 (填“a”或“b”);
③使用温度计的目的是 。
(5)在实验中原料用量:2.0g水杨酸、5.0mL醋酸酐(
最终称得产品质量为2.2g,则所得乙酰水杨酸的产率为 (百分数精确到0.1)。
正确答案
(1)水浴加热(2分)
(2)
(3)
(4)
(5)
解析
略
知识点
利用酸解法制钛白粉产生的废液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4],生产铁红和补血剂乳酸亚铁。其生产步骤如下:
已知:TiOSO4可溶于水,在水中可以电离为TiO2+和SO42—。
请回答:
(1)步骤①中分离硫酸亚铁溶液和滤渣的操作所用的玻璃仪器是____ 。
步骤②得到硫酸亚铁晶体的操作为蒸发浓缩、______________________________。
(2)步骤④的离子方程式是 ___________________________________ 。
(3)步骤⑥必须控制一定的真空度,原因是有利于蒸发水以及 _______ 。
(4)硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为 ______ 。
(5)用平衡移动的原理解释步骤⑤中加乳酸能得到乳酸亚铁的原因 _______ 。
(6)为测定步骤②中所得晶体中FeSO4·7H2O的质量分数,取晶体样品a g,溶于稀硫酸配成100.00 mL溶液,取出20.00 mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.1000 mol•L-1 KMnO4溶液20.00 mL,所得晶体中FeSO4·7H2O的质量分数为(用a表示) —————————— 。
正确答案
(1)玻璃棒、漏斗、烧杯 降温结晶
(2)Fe2++2HCO3—→FeCO3↓+H2O+CO2↑
(3)防止Fe2+被氧化
(4)1: 4
(5)FeCO3(s) 
(6)13.9/a
解析
略
知识点
下列实验设计能够成功的是
正确答案
解析
略。
知识点
用下列有关实验装置进行的相应实验中,能达到实验目的的是
图1 图2 图3 图4
正确答案
解析
略
知识点
扫码查看完整答案与解析