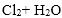- 氯气的实验室制法
- 共24题
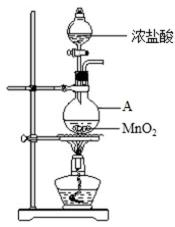
下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。
(1)装置A是氯气的发生装置,请写出相应反应的化学方程式:_______。
(2)装置B中饱和食盐水的作用是_______;同时装置B也是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:_______。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III处依次放入物质的组合应是_______(填字母编号)。
(4)设计装置D、E的目的是比较氯、溴、碘单质的氧化性。反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是_______,该现象_______(填“能”或“不能”)说明溴单质的氧化性强于碘,原因是_______。
(5)装置F的作用是_______,其烧杯中的溶液不能选用下列中的_______(填字母编号)。
A.饱和NaOH溶液
B.饱和Ca(OH)2溶液
C.饱和Na2SO3溶液
D.饱和Na2CO3溶液
正确答案
(1)Ca(ClO) 2+4HCl(浓)=CaCl2+2Cl2↑+2H2O
(2)除去Cl2中的HCl;B中长颈漏斗中液面上升,形成水柱
(3)d
(4)E中溶液分为两层,上层(苯层)为紫红色;不能;过量的Cl2也可将I-氧化为I2
(5)吸收余氯,防止污染大气;b
解析
略。
知识点
研究小组用下图装置制取Cl2,证明产生的气体中含有HCl。
(1)仪器A的名称为 ;
A中反应的离子方程式为 。
(2)甲同学将A中产生的气体通入下列溶液:
①实验a中的现象为 。
②不能证明产生的气体中含有HCl的实验是 (填字母序号)。
(3)已知将HCl气体通入饱和食盐水中有白色固体析出。乙同学将A中产生的气体通入饱和食盐水中,有白色固体析出,但该实验不能证明气体中含有HCl,结合化学用语解释其原因: 。
(4)已知:2S2O32- + I2 === S4O62- + 2I-。丙同学将A中产生的气体通入蒸馏水中,得到溶液X,进行以下实验证明气体中含有HCl。
I.测定X中溶解的Cl2。取25.00 mL溶液X,加入过量KI溶液,然后用0.04 mol•L-1 Na2S2O3溶液滴定生成的I2,达滴定终点时消耗Na2S2O3溶液V mL。
II.测定X中Cl元素总量。另取25.00 mL溶液X,选用适当的还原剂将溶解的Cl2全部还原为Cl-,再用0.10 mol•L-1 AgNO3溶液滴定所得溶液中的Cl-。
① X中的HClO不会影响I的测定结果,原因是 。
② 由I、II 中实验数据可证明A中产生的气体中含有HCl,则II中消耗0.10 mol•L-1 AgNO3溶液的体积应大于 mL(用含V的代数式表示)。
正确答案
见解析。
解析
(1)圆底烧瓶 MnO2 + 4H++ 2Cl-
(2)①溶液先变红再褪色
②a、b
(3)Cl2+ H2O
(4)
①答案一:生成1 mol HClO需消耗1 mol Cl2, HClO也有氧化性,1 mol HClO和1 mol Cl2均能将2 mol KI氧化成I2。
答案二:


②0.4V
知识点
29.二氧化锰(MnO2)与浓盐酸混合加热可得到氯气、氯化锰等,下图是制取并探究Cl2化学性质的装置图。
(1)写出圆底烧瓶中反应的化学方程式 ( )。
(2)A中m管的作用是 ( );装置F的作用是 ( )。
(3)若要得到干燥纯净的气体,则B中应盛放的试剂是( ),C中应盛放的试剂是 ( ) 。
(4)E中若装有FeCl2溶液,反应的离子方程式为 ( );E中若装有淀粉碘化钾溶液,能观察到的实验现象是 ( )。
(5)实验中发现:浓盐酸与MnO2混合加热生成氯气,稀盐酸与MnO2混合加热不生成氯气。针对上述现象,化学小组对“影响氯气生成的原因”进行了讨论,并设计了以下实验方案:
a.稀盐酸滴入MnO2中,然后通人HCl气体,加热
b.稀盐酸滴人MnO2中,然后加入NaCl固体,加热
c.稀盐酸滴入MnO2中,然后加入浓硫酸,加热
d.MnO2与NaCl的浓溶液混合,加热
e.浓硫酸与NaCl固体、MnO2固体共热
①实验b的目的是( );实验c的目的是( ) 。
②实验现象:a、c、e有黄绿色气体生成,b、d没有黄绿色气体生成。由此得出影响氯气生成的原因是 ( )。
29.二氧化锰(MnO2)与浓盐酸混合加热可得到氯气、氯化锰等,下图是制取并探究Cl2化学性质的装置图。
(1)写出圆底烧瓶中反应的化学方程式 。
(2)A中m管的作用是 ;装置F的作用是 。
(3)若要得到干燥纯净的气体,则B中应盛放的试剂是 ,C中应盛放的试剂是 。
(4)E中若装有FeCl2溶液,反应的离子方程式为 ;E中若装有淀粉碘化钾溶液,能观察到的实验现象是 。
(5)实验中发现:浓盐酸与MnO2混合加热生成氯气,稀盐酸与MnO2混合加热不生成氯气。针对上述现象,化学小组对“影响氯气生成的原因”进行了讨论,并设计了以下实验方案:
a.稀盐酸滴入MnO2中,然后通人HCl气体,加热
b.稀盐酸滴人MnO2中,然后加入NaCl固体,加热
c.稀盐酸滴入MnO2中,然后加入浓硫酸,加热
d.MnO2与NaCl的浓溶液混合,加热
e.浓硫酸与NaCl固体、MnO2固体共热
①实验b的目的是 ;实验c的目的是 。
②实验现象:a、c、e有黄绿色气体生成,b、d没有黄绿色气体生成。由此得出影响氯气生成的原因是 。
正确答案
28.氯气和二氧化硫是中学化学中常见的气体。某活动小组设计如下图所示装置图,分别研究氯气和二氧化硫的性质。
(1)下列装置常用于实验室制取气体,其中制取氯气选用的装置为( ),反应的离子方程式为 ( ),制取二氧化硫选用的装置为( );
(2)从左端分别通入氯气或二氧化硫时,装置B中观察到的现象是否相同( )(填“相同”或“不相同”);装置A反应后溶液均褪色,如何利用褪色后的溶液判断是何种气体使其褪色(写出简要的实验步骤) ( );
(3)装置F中盛放的溶液为( );若装置E中试剂为铁丝,则通入氯气
(4)当通入足量SO2完全反应后,向C中滴加淀粉溶液,无明显现象。该反应的离子方程式为 ( )。
正确答案
(1)甲 (1分);
(2)
(3)
(4)
解析
解析已在路上飞奔,马上就到!
知识点
29.某实验小组开展自主实验活动,学校实验室提供如下实验试剂和实验装置:实验试剂:A.浓盐酸 B.稀盐酸 C.浓硫酸 D.稀硫酸 E.MnO2粉末 F.
实验装置:
I.该小组拟制备Cl2和SO2两种气体,请为其选择适当的试剂和装置(用字母表示)并填入下表:
上述制备Cl2的反应的离子方程式是:( )。
II.该小组进一步探究Cl2和SO2两种气体的化学性质,设计如图装置。
首先将C中少量SO2通入B中,请书写SO2与过量NaOH稀溶液反应的化学方程式:(
);为验证此时溶液中大量存在的阴离子,该小组又设计了若干实验方案,其实验简要操作及结论是:( ) 。待SO2与过量NaOH稀溶液反应完全后再将过量Cl2通入B中充分反应,此时溶液中一定能大量存在的阴离子是:( )。(不考虑空气中的CO2的影响)
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析