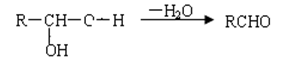- 有机物的推断
- 共316题
16.下图是以石油为原料的部分转化流程:
已知:
(1)反应①的类型是:( )
(2)由乙烯制备乙醇的过程中,硫酸起( )作用
(3)写出反应③的化学方程式:( )
(4)写出C3H5Br2Cl与NaOH溶液完全反应的有机产物与足量乙酸反应的化学方程式:( )。
正确答案
(1)加成反应(2分)
(2)催化(2分)
(3)
(4)
解析
解析已在路上飞奔,马上就到!
知识点
30.已知A的蒸汽对氢气的相对密度为35,把0.2摩尔A在足量氧气中完全燃烧的产物通过盛足量浓硫酸的洗气瓶,洗气瓶增重10.8克,再通过盛足量碱石灰的干燥管,干燥管增重35.2克,化合物M是一种医用高分子材料,可用于制造隐形眼镜;以下是M、有机玻璃的原料H的合成路线。
已知:
(1)E与H2加成后的产物的一个分子中含有三个甲基;
(2)H在一定条件下可氧化为A;
请回答下列问题:
(1)A中含有的官能团的名称__________________,G → H的反应条件是______________,
E分子中最多能共平面的原子为________个;
(2)写出A、M的结构简式:A_______________________,M_____________________________;
(3)写出下列方程式:
B→C ____________________________________________________
F→天然橡胶 _____________________________________________
(4)B有多种同分异构体,其中属于链状酯的同分异构体有______种。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
30. G是黄酮类药物的主要合成中间体,可由A(

已知以下信息:
①C不能发生银镜反应。
② 

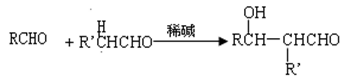
③ RCOCH3+R'CHORCOCH=CHR'
回答下列问题:
(1)A的化学名称为( ),1mol A最多可跟( )mol H2发生反应。
(2) D的含氧官能团的名称是( ),由E生成F的反应类型为( ) 。
(3)由B生成C的化学方程式为( ) 。
(4) G的结构简式为( )。
(5)H是F的同分异构体,符合下列条件,写出H的结构简式( )。
①能发生银镜反应。
②能与FeCl3溶液发生显色反应。
③苯环上的一氯代物只有2种。
正确答案
(1)苯乙烯(2分);4(2分)
(2)羟基、醛基(2分); 取代反应(2分)
(3)
(4)
(5)
解析
解析已在路上飞奔,马上就到!
知识点
请考生从给出的3道物理题、3道化学题、2道生物题中每科任选一题做答。
36.以硫酸工业的SO2尾气、氨水、石灰石、焦炭、碳酸氢铵和氯化钾等为原料,可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质。合成路线如下:
(1)写出反应Ⅰ的化学方程式 ( ) 。
(2)生产中,向反应II中的溶液中加入适量还原性很强的对苯二酚等物质,其目的是( )。
(3)下列有关说法正确的是( ) 。
a.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙
b.反应III中氧化剂与还原剂的物质的量之比为4︰1
c.反应IV需控制在60~
d.反应V中的副产物氯化铵可用作氮肥
(4)反应Ⅴ在25℃、40%乙二醇溶液中进行,不断有硫酸钾晶体从溶液中析出,硫酸钾的产率会超过90%,选用40%乙二醇溶液的原因是( )。
(5)(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,写出二氧化氮与亚硫酸铵反应的化学方程式( ) 。37.[Cu(NH3)4]SO4·H2O是一种杀虫剂。
(1)Cu元素基态原子的电子排布式为___ ____。
(2)元素N、O、S的第一电离能由大到小排列的顺序为___ __。
(3)H元素可与O元素形成H2O和H2O2,H2O2易溶于H2O,其主要原因为___ ___。
(4)H元素与N元素可组成化合物N2H4,其中N原子的轨道杂化方式为___ ___。
(5)与SO互为等电子体的一种分子的化学式为 ___ ___。
(6)Cu元素与H元素可形成一种红色晶体,其结构如图8,则该化合物的化学式为__ __。38.菠萝酯是一种具有菠萝香气的食用香料,是化合物甲与苯氧乙酸
(1)甲一定含有的官能团的名称是( ) 。
(2)5.8g甲完全燃烧可产生0.3mol CO2和0.3 mol H2O,甲蒸气对氢气的相对密度是29,甲分子中不含甲基,且为链状结构,其结构简式是( )。
(3)苯氧乙酸有多种酯类的同分异构体,其中能与FeCl3溶液发生显色反应,且有2种一硝基取代物的同分异构体是(写
(4)已知:R-C

R-ONa
菠萝酯的合成路线如下:
①试剂X不可选用的是(选填字母)( ) 。
a. CH3COONa溶液
b. NaOH溶液
c. NaHCO3溶液
d.Na
②丙的结构简式是 ( ),反应II的反应类型是 ( ) 。
③反应IV的化学方程式是( ) 。
37.[Cu(NH3)4]SO4·H2O是一种杀虫剂。
(1)Cu元素基态原子的电子排布式为___ ____。
(2)元素N、O、S的第一电离能由大到小排列的顺序为___ __。
(3)H元素可与O元素形成H2O和H2O2,H2O2易溶于H2O,其主要原因为______。
(4)H元素与N元素可组成化合物N2H4,其中N原子的轨道杂化方式为___ ___。
(5)与SO互为等电子体的一种分子的化学式为___ ___。
(6)Cu元素与H元素可形成一种红色晶体,其结构如图8,则该化合物的化学式为____。
38.菠萝酯是一种具有菠萝香气的食用香料,是化合物甲与苯氧乙酸
(1)甲一定含有的官能团的名称是( )。
(2)5.8g甲完全燃烧可产生0.3mol CO2和0.3 mol H2O,甲蒸气对氢气的相对密度是29,甲分子中不含甲基,且为链状结构,其结构简式是 ( )。
(3)苯氧乙酸有多种酯类的同分异构体,其中能与FeCl3溶液发生显色反应,且有2种一硝基取代物的同分异构体是(写出任意2种的结构简式)( ) 。
(4)已知:
菠萝酯的合成路线如下:
①试剂X不可选用的是(选填字母)( ) 。
a. CH3COONa溶液
b. NaOH溶液
c. NaHCO3溶液
d.Na
②丙的结构简式是( ),反应II的反应类型是( ) 。
③反应IV的化学方程式是( ) 。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
30.已知:

请回答下列问题:
(1)
(2)A反应生成B需要的无机试剂为( ) 。
上图所示反应中属于取代反应的共有( ) 个。
(3)B和O2反应生成C的化学方程式为( ) 。
(4)F的结构简式为( )。
(5)写出与G互为同分异构体的所有链状烃的结构简式(G除外) ( )、( ) 。
正确答案
(1)醛基、碳碳双键
(2)强碱的水溶液或NaOH的水溶液或KOH的水溶液 3个
解析
解析已在路上飞奔,马上就到!
知识点
29.烯烃通过臭氧化并经锌和水处理得到醛和酮。例如:
Ⅰ.已知丙醛的燃烧热为1815kJ/mol,丙酮的燃烧为1789 kJ/mol,试写出丙醛燃烧的热化学方程式( )。
Ⅱ.上述反应可用来推断烯烃的结构,一种链状单烯烃A(C8H16)通过臭氧化并经锌和水处理得到B和C。化合物B含碳69.8%,含氢11.6%,B无银镜反应,催化加氢生成D,D在浓硫酸存在下加热,可得到能使溴水褪色且只有一种结构的物质E 。反应图示如下:
回答下列问题:
(1)B的相对分子质量是( );C→F的反应类型为( ),D中含有官能团的名称 ( ) 。
(2)D+F→G的化学方程式是:( ) 。
(3)A的结构简式为 ( )。
(4)化合物A的某种同分异构体通过臭氧化并经锌和水处理得到一种产物,符合该条件的异构体的结构简式有( )种。
29.烯烃通过臭氧化并经锌和水处理得到醛和酮。例如:
Ⅰ.已知丙醛的燃烧热为1815kJ/mol,丙酮的燃烧为1789 kJ/mol,试写出丙醛燃烧的热化学方程式 。
Ⅱ.上述反应可用来推断烯烃的结构,一种链状单烯烃A(C8H16)通过臭氧化并经锌和水处理得到B和C。化合物B含碳69.8%,含氢11.6%,B无银镜反应,催化加氢生成D,D在浓硫酸存在下加热,可得到能使溴水褪色且只有一种结构的物质E 。 反应图示如下:
回答下列问题:
(1)B的相对分子质量是 ;C→F的反应类型为 ,D中含有官能团的名称 。
(2)D+F→G的化学方程式是: 。
(3)A的结构简式为 。
(4)化合物A的某种同分异构体通过臭氧化并经锌和水处理得到一种产物,符合该条件的异构体的结构简式有 种。
正确答案
30.以A:
回答下列问题:
(1) 1 molA完全燃烧要消耗( )mol 氧气,若与足量金属钠反应能生成( ) mol氢气。
(2)写出反应①的类型:( );D的结构简式:( )。
(3) 写出B→C反应的化学方程式为 ( ) 。
(4) 反应①、②的目的是 ( ) 。
(5) 写出满足下列条件的A的一种同分异构体的结构简式 ( ) 。
a.不溶于水 b.能发生银镜反应 c.含有 —C(CH3)3
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
7.分子式为C5H10O2的有机物A有下列变化关系
其中B、C的相对分子质量相等,则B为( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
请从36~38题中任选一题作答
36.【化学_选修2:化学与技术】工业生产纯械的工艺流程示意图如下
完成下列填空:
(1)粗盐水加入沉淀剂A、B除杂质(A来源于石灰窑厂),则B的化学式( )。
(2)②过滤后滤液中要通入C和D气体,则先通入的C气体是( )(填化学式),原因是( )。
(3)通入C和D气体后发生反应的化学方程式是 ( ) 。
(4)④过滤后,向滤液中通氨气,加入细小食盐颗粒,析出副产品 ( )(填写化学式),通氨气与加入细小食盐颗粒的作用是( ) 。
(5)写出⑤锻烧发生反应的化学方程式( )产品纯碱中含有碳酸氢钠。若用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数ω(NaHCO3)= ( )。[加热前后的质量分别用m(加热前)和m(加热后)表示]
37.【化学——选修物质结构与性质】元素周期表是研究元素原子结构及性质的重要工具。现有X、Y和Z三种元素,其原子序数依次减小。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子,X跟Y可形成化合物X2Y3。Z元素既可以形成正一价离子也可形成负一价离子。请回答下列问题:
(1)Y元素原子的价层电子的轨道表示式为( ),该元素的名称是( );
(2)在X与Z形成的化合物XZ3中,X的杂化类型是( ),该化合物的空间构型为( );短周期元素形成的化合物中与XZ3互为等电子体的是( );
(3)请写出X的两种含氧酸的化学式 ( ) 、( ),其中酸性较强的是( )。
(4)Q与Z同主族。Q单质的晶胞如下图所示,若设该晶胞的密度为ag/cm3,阿伏加德罗常数为NA,Q原子的摩尔质量为M,则表示Q原子半径的计算式为 ( )。
38.【化学一选修有机化学基础】化合物Ⅴ是中药黄芩中的主要活性成分之一,具有抗氧化和抗肿瘤作用。化合物Ⅴ也可通过下图所示方法合成:
(1)反应①属于( )(填反应类型)。
(2)化合物Ⅰ的分子式为( ),Ⅴ中含有的含氧官能团的名称为
(3)合成化合物Ⅱ的方法为:
合成肉桂酸的反应式中,反应物的物质的量之比为1︰1,生成物A呈酸性,写出A的一种同分异构体的结构简式 ( ) 。
(4)化合物Ⅰ和Ⅱ反应还可以得到一种酯,写出该反应的化学方程式 ( )。
(5)下列关于化合物Ⅴ的说法正确的是( )(双选,填字母)。
A.分子中有三个苯环
B.能发生水解反应
C.使酸性KMnO4溶液褪色
D.与FeCl3发生显色反应
(6)写出肉桂酸的两种同分异构体,满足①分子中含有苯环,②羧基与苯环直接相连。(书写的异构体中含有相同的官能团,写成邻、
正确答案
36.
37.
38.
解析
解析已在路上飞奔,马上就到!
知识点
第18、19、20三题中任选一题做答,如果多做,则按所做的第一题计分。
18.(I)多项选择题:下列实验方案可行的是( )
A.在淀粉溶液中加稀硫酸充分反应后,再加入银氨溶液,可检验淀粉的水解产物
B.用溴水可以鉴别苯、乙醇、四氯化碳三种液体
C.除去苯中的苯酚,可加入NaOH溶液后再分液
D.将氯乙烷与NaOH的乙醇溶液共热,将产生的气体直接通入酸性高锰酸钾溶液中,溶液褪色,证明氯乙烷发生了消去反应
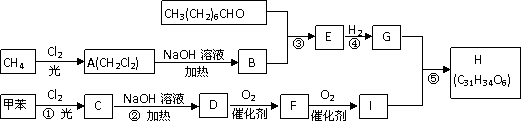
(II)一种用于治疗高血脂的新药——灭脂灵可按如下路线合成:
已知:①
②一个碳原子上同时连接两个羟基,立即失去一份水,生成另一种物质,如:
又知G的分子式为C10H22O3,试回答:
(1)写出D、E的结构简式:D( )E( )。
(2)B的官能团的名称( ),反应⑤的反应类型( )。
(3)CH3(CH2)6CHO有多种同分异构体, 符合下列要求的所有结构简式( )。
A.能发生银镜反应 B.烃基上的一氯取代物只有两种
(4)鉴别F和I的方法是( )
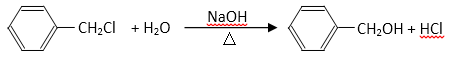
(5)反应②的化学方程式为( )。
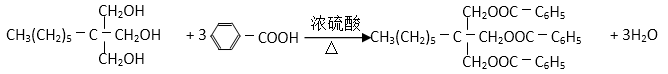
(6)反应⑤的化学方程式为( )。
19.(I)多项选择题:下列说法中正确的是( )。
A.第一电离能由大到小的顺序为O > N > C
B.由于C22—和O22+为等电子体,所以可以判断O22+的电子式为
C.NO3—中N采用sp2杂化,故NO3—的空间构型为三角锥形
D.液态HF通常也可以写成(HF)n的形式,是因为液态HF分子间存在氢键
(II)氮元素可形成很多重要的化合物,其中叠氮化钠(NaN3)被广泛应用于汽车安全气囊。叠氮化钠的制取方法是:①金属钠与液态氨反应得NaNH2②NaNH2与N2O按物质的量2:1反应可生成NaN3、NaOH和一种气体。
(1)请写出反应②的化学方程式为:( )。
(2)与N3-互为等电子体的分子有:( )(写一种)由此可推知N3-的空间构型是:( );比较NH2-和NH3的键角∠HNH的大小:NH2-( )NH3,请用价层电子对互斥规律解释:( )。
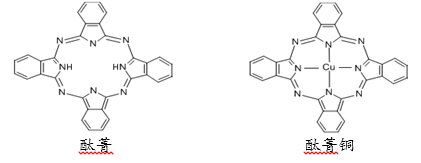
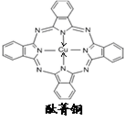
(3)氮的化合物酞箐和铜酞箐(环中含有一个铜原子)是重要的有机染料,相关分子结构如图所示:
酞箐分子中氮原子的杂化类型有:( )铜酞箐中铜原子在基态时的价电子排布式:( );请在图中用“→”标出铜酞箐中的配位键( )。
(4)小汽车的防撞气囊中叠氮化钠的工作原理是基于反应:6NaN3+ Fe2O3=3Na2O+2Fe+9N2;铁晶体有三种堆积方式,其中两种堆积方式分别如图甲、图乙所示(其晶胞特征如其右图所示):
晶胞甲中铁原子的堆积方式为:( ),晶胞乙中铁原子的配位数为:( )。铁原子半径为a cm,NA表示阿伏加德罗常数,摩尔质量为Mg/mol。则该晶体的密度可表示为:( )g/cm3。
20.(I)多项选择题:下列关于金属冶炼说法正确的是( )
A.工业上一般以铁矿石、焦炭、石灰石和空气等原料在高炉中冶炼生铁
B.炼钢主要目的是在高温下用还原剂将过多的碳和其他杂质还原成气体或炉渣除去
C.炼钢中添加硅、锰、铝等作为脱氧剂,调整钢水的成分,制成多种性能优良的钢材
D.电解铝时阴极材料需要定期更换
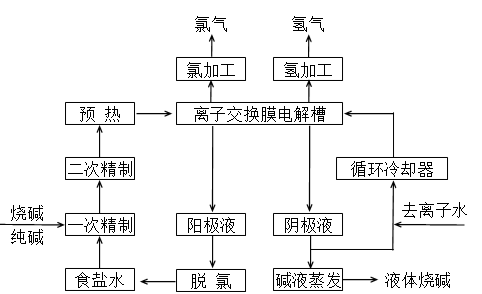
(II)氯碱工业是最基本的化学工业之一,离子膜电解法为目前普遍使用的生产方法,其生产流程如下图所示:
(1)该流程中可以循环的物质是( ) 。
(2)电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有Ca2+、Mg2+、SO42-等无机杂质,所以在进入电解槽前需要进行两次精制,写出一次精制中发生的离子方程式( ),若食盐水不经过二次精制就直接进入离子膜电解槽会产生什么后果( ) 。
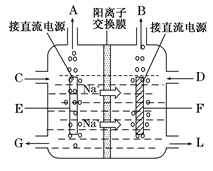
(3)图是工业上电解饱和食盐水的离子交换膜电解槽示意图(阳极用金属钛网制成,阴极由碳钢网制成)。则B处产生的气体是( ),E电极的名称是( )。电解总反应的离子方程式为( )。
(4)从阳极槽出来的淡盐水中,往往含有少量的溶解氯,需要加入8%~9%的亚硫酸钠溶液将其彻底除去,该反应的化学方程式为( )。
(5)已知在电解槽中,每小时通过1安培的直流电可以产生1.492g的烧碱,某工厂用300个电解槽串联生产8小时,制得32%的烧碱溶液(密度为1.342吨/m3)113m3,电解槽的电流强度1.45 ×104A,该电解槽的电解效率为( ) 。
正确答案
18.(I) BC(6分,答对1个得3分,答错得0分。)
(II)
(1)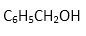
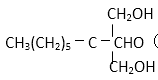
(2)醛基(1分) ; 取代反应(1分)
(3)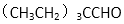
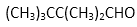
(4)把F和 I配成溶液 ,分别滴加紫色石蕊试液,如变红的是苯甲酸(即I),不变色的是苯甲醛(即F)。或者是蓝色石蕊试纸、银镜反应、新制氢氧化铜悬浊液等,其它合理均给分。(2分)
(5)
(6)
19.(I)BD(6分,答对1个得3分,答错得0分。)
(II)
(1)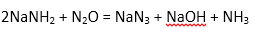
(2)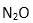
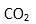
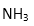
(3)
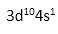
(4)体心立方堆积(1分) ; 12(1分); 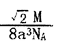
20.(I)AC(6分,答对1个得3分,答错得0分。)
(II)
(1)氯化钠 氢氧化钠 (2分)
(2)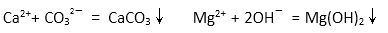
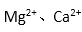
(3)
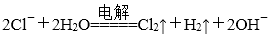
(4)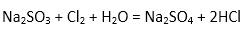
(5)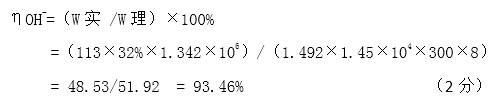
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析