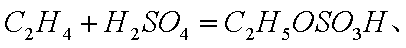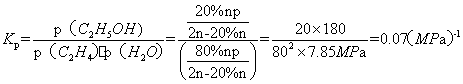- 盖斯定律的计算
- 共35题
氢气是清洁的能源,也是重要的化工原料。
(1)以H2为原料制取氨气进而合成CO(NH2)2的反应如下:
N2(g)+3H2(g)=2NH3(g) △H=―92.40 kJ·mol-1
2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=―159.47 kJ·mol-1
NH2CO2NH4(s)=CO(NH2)2(s)+H2O (l) △H=+72.49 kJ·mol-1
则N2(g)、H2(g)与CO2(g)反应生成CO(NH2)2(s)和H2O(l)的热化学方程式为 。
(2)CO在催化剂作用下可以与H2反应生成甲醇CO(g)+2H2(g) 
①M、N两点平衡状态下,容器中总物质的物质的量之比为:n(M):n(N)= 。
②若M、N、Q三点的平衡常数KM、KN、KQ的大小关系为 。
(3)已知叠氮酸(HN3)不稳定,同时也能与活泼金属反应,反应方程式为:
2HN3=3N2↑+H2↑ 2HN3+Zn=Zn(N3)2+H2↑
则2 mol HN3与一定量Zn完全反应,在标准状况下生成67.2 L气体,其中N2的物质的量为 。
(4)已知H2S高温热分解制H2的反应为: H2S(g)

(5)用惰性电极电解煤浆液制H2的反应为: C(s)+2H2O(l)=CO2(g)+2H2(g) 现将一定量的1 mol·L-1 H2SO4溶液和适量煤粉充分混合,制成含碳量为0.02 g·mL-1~0.12g·mL-1的煤浆液,置于上图2所示装置中进行电解(两电极均为惰性电极),则A极的电极反应式为 。
正确答案
(1)
(2)① 5:4 ②KM=KN>KQ
(3)2 mol
(4) 0.4c/t mol·L-1·min-1;温度升高,反应速率加快,达到平衡所需的时间缩短(合理答案均可)
(5)C+2H2O-4e-=CO2↑+4H+
解析
略
知识点
乙醇是重要的有机化工原料.可由乙烯气相直接水合法或间接水合法生产。回答下列问题:
(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H),再水解生成乙醇写出相应反应的化学方程式 。
(2)已知:
甲醇脱水反应:2CH3OH(g)= CH3OCH3(g)+ H2O(g) △H1=-23.9KJ·mol-1
甲醇制烯经反应:2CH3OH(g)= C2H4(g)+2 H2O(g) △H2=-29.19KJ·mol-1
乙醇异构化反应: C2H5OH(g)= CH3OCH3(g) △H3=+50.7KJ·mol-1
则乙烯气相直接水合反应:C2H4(g)+ H2O(g)= C2H5OH(g)的△H= KJ·mol-1与间接水合法相比,气相直接水合法的优点是_
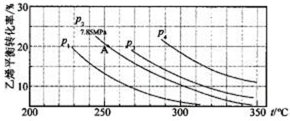
(3)下图为气相直接水合法中乙烯的平衡转化率与温度.压强的关系[其中N(H2O):N(C2H4)=l:1]。
①列式计算乙烯水合制乙醇反应在图中A点的平衡常数Kp= (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
②图中压强(P1.P2.P3.P4)的大小顺序为_ ,理由是_ .
③气相直接水合法常采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度290℃.压强69MPa:气。N(H2O):N(C2H4)=0.6 :1。乙烯的转化率为5%.若要进一步提高乙烯转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有 . 。
正确答案
(1)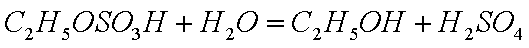
(2)-45.5 污染小、腐蚀性小等
(3)①
②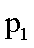
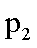
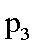
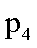
③将产物乙醇液化移去 增加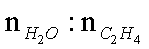
解析
略
知识点
火力发电厂释放出大量气体会造成环境污染。对燃煤废气进行处理,可实现绿色环保、废物利用等目的。
(1)CO可以与H2O(g)发生反应:CO(g) + H2O(g) 
在甲、乙、丙三个恒容密闭容器中,起始时按照下表进行投料,在800℃时达到平衡状态,K=1.0。
①该反应的平衡常数表达式为 。
②平衡时,丙容器中H2O的物质的量是 mol,甲容器中CO的转化率是 ,
容器中CO的转化率:乙 甲(填“>”、“=”或“<”)。
③丙容器中,其他条件不变时,温度 (填“升高”或“降低”),CO的平衡转化率升高。
(2)除去氮氧化物:
① 利用甲烷催化还原NOx:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160 kJ·mol-1
甲烷直接将NO2还原为N2的热化学方程式为__________
② 也可用氨气与之发生反应:NOx+NH3→N2+H2O。
现有NO2和NO的混合气体3.0 L,跟3.4 L(同温同压下)NH3反应,恰好使其全部转化为氮气,则原混合气体中,NO2与NO的体积比是__________。
正确答案
见解析。
解析
(1)①
②0.1 50% >
③ 降低
(2)①CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol (3分)
② 7 : 3
知识点
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用焦炭与水蒸气在高温下的反应产物(水煤气)合成二甲醚。请回答下列问题:
(1)制水煤气的主要化学反应方程式为: 。
(2)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为: 。
(3)利用水煤气合成二甲醚的三步反应如下:
① 2H2(g)


② 2CH3OH(g)


③ CO(g)



总反应:3H2(g)




一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是
(填字母代号)。
a,低温高压 b,加入催化剂 c,减少CO2的浓度 d,增加CO的浓度
(4)已知某温度下反应②2CH3OH(g)

比较此时正、逆反应速率数值(单位相同)的大小:

反应开始时

该时间内的平均反应速率

该温度下反应的平衡常数值为 。(精确到0.01)
正确答案
(1)C +H2O 
(2)H2S+Na2CO3 →NaHS + NaHCO3
(3)246.4 a c
(4) > 1.64 mol·L-1 0.12mol/L·min 1.86
解析
略
知识点
25℃、101kPa 下:
①2Na(s)+1/2O2(g)→Na2O(s)+414KJ
②2Na(s)+O2(g)→Na2O2(s)+511KJ下列说法正确的是()
正确答案
解析
略
知识点
扫码查看完整答案与解析