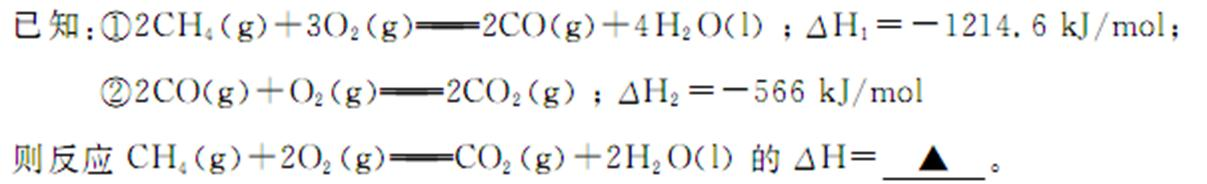- 盖斯定律的计算
- 共35题
11.现在科学家正在寻求将太阳能转化成化学能,其中办法之一就是利用太阳能将H2O分解成H2,再将化学能转化为其它能源。下面是有关的能量循环示意图,下列有关说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27.新的《环境空气质最标准》(GB3095-2012)将于2016年1月1日在我国全面实施。据此,环境空气质量指数(AQI)日报和实时报告包括了SO2、NO2、CO、O3、PM10、PM2.5等指标,为公众提供健康指引,引导当地居民合理安排出行和生活。
(1)汽车排出的尾气中含有CO和NO等气体,用化学方程式解释产生NO的原因____。
(2)汽车排气管内安装的催化转化器,可使汽车尾气中的主要污染物转化为无毒的大气循环物质。已知:
则反应
该反应的△S_____________0(填“>”、“<”或“=”)。
(3)将0.20molNO和0.10 molCO充入一个容积恒定为1L的密闭容器中,在不同条件下反应过程中部分物质的浓度变化状况如图所示。
①计算产物N2在6~9min时甲均反应速率v(N2)= ______mol·L-1·min-1;
②第12min时改变的反应条件为 ________(填“升温”、“降温”)
③计算反应在第24min时的平衡常数K=_________。若保持温度不变,再向容器中充入CO、N2各0.060mol,平衡将____移动(填“正向”、“逆向”或“不”)。
(4)环境监测中还可用沉淀法测定空气中含有较高浓度SO2的含量,经查得一些物质在20℃的数据如下表:
④吸收SO2最合适的试剂是___________[填“Ca(OH)2”或“Ba(OH)2”]溶液:
②在20℃时,向CaSO3悬浊液中滴加适最的BaCl7溶液,当CaSO3向BaSO3的转化达到平衡时,溶液中的
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
12.用CH4催化还原NO,可以消除氮氧化物的污染。例如:

正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27.汽车安全气囊在初次发生猛烈碰撞后的几十毫秒内迅速打开,可有效缓冲驾驶员和前排乘客所遭受的冲击力度,保护其头部不受伤害。汽车安全气囊中含有MYn和红棕色金属氧化物、SiO2等物质。M、Y为短周期元素,其最外层电子数之和等于氧原子的最外层电子数,且可发生下图的转化关系。
(1)在2L密闭容器中投入2molY2和3.5molH2发生反应Ⅱ,测得YH3的物质的量在温度T1、 T2下随时间的变化如表所示:
① 已知该反应△H<0,则T1 T2 (填“>”、“<”或“=”);
②在温度T2下,达到平衡时YH3的平均速率v(YH3)= ( );平衡常数为( )(保留两位有效数字)。
③T2温度下达到平衡后,将容器的容积压缩到原来的1/2.在其他条件不变的情况下,对平衡体系产生的影响是 ( ) 。(填字母)。
A.c(H2)减少 B.正反应速率加快,逆反应速率减慢
C.YH3的物质的量增加 D.重新平衡时c(H2)/c(YH3)减小
(2) Y2H4是一种可燃性的液体,可用作火箭燃料。
①已知:N2(g)+2O2(g)==2NO2(g);△H= +67.7 kJ·mol-1
2N2H4(g)+2NO2(g) = 3N2(g) + 4H2O(g) △H=-1135.7 kJ·mol-1
计算反应:N2H4(g)+O2(g)==N2(g)+2H2O(g)△H=( ) kJ·mol-1
②水的电离方程式也可写为:H2O+H2O H3O++OH-,若液态Y2H4能够按照类似方式电离,请写出电离方程式:___________________________________。
③传统制备Y2H4的方法,是以MClO氧化YH3制得。反应Ⅲ的离子方程式是__________。
(3)Y2H4-空气燃料电池是一种高能电池,用20%-30%的KOH充当电解质溶液,则电池放电时的负极的电极反应式是 ( )。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
26.(Ⅰ)碳和碳的化合物在人类生产、生活中的应用非常广泛。“低碳生活”不再只是一种理想,更是一种值得期待的生活方式。
(1)甲烷燃烧时放出大量的热,可作为能源应用于人类的生产和生活。
(2)将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。
其负极电极反应式是:叁一。
(3)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应:

①实验1中,以v( H2)表示的平均反应速率为:( )。
②该反应的正反应为( )(填“吸”或“放”)热反应;
③若要实验3达到与实验2相同的平衡状态(即各物质的体积分数分别相等),则a、b应满足的关系是( )(用含a、b的数学式表示)。
(Ⅱ)某小组运用工业上离子交换膜法制烧碱的原理,用如下图所示装置电解K2 SO4溶液。
①该电解槽中通过阴离子交换膜的离子数( )(填“>”“<”或“一”)通过阳离子交换膜的离子数;
②图中a、b、c、d分别表示有关溶液的pH,则a、b、c、d由小到大的顺序为( );
③电解一段时间后,B出口与C出口产生气体的质量比为( )。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析