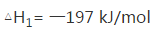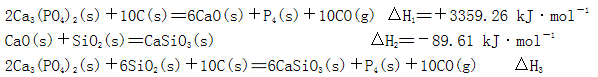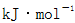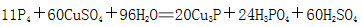- 盖斯定律的计算
- 共35题
某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变为H2、CO。其过程如下:
mCeO2 
(m-x)CeO2·xCe +xH2O + xCO2
下列说法不正确的是
正确答案
解析
略
知识点
捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
请回答下列问题:
(1)△H1与△H2、△H3之间的关系是:△H3= 。
(2)为研究温度对(NH4)2CO3捕获CO2气体效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),在t时刻,测得容器中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,保持其它初始实验条件不变,重复上述实验,经过相同时间测得CO2气体浓度,得到趋势图(见图1)。则:
①△H3 0(填“>”、“=”或“<”)。
②在T1-T2及T4- T5二个温度区间,容器内CO2气体浓度呈现如图1所示的变化趋势,其原因是 。
③反应Ⅲ在温度为T1时,溶液pH随时间变化的趋势曲线如图2所示。当时间到达t1时,将该反应体系温度迅速上升到T2,并维持该温度。请在该图中画出t1时刻后溶液的pH变化趋势曲线。
(3)利用反应Ⅲ捕获CO2,在(NH4)2CO3初始浓度和体积确定的情况下,提高CO2吸收量的措施有 (写出2个)。
(4)下列物质中也可能作为CO2捕获剂的是
aNH4Cl
bNa2CO3
cHOCH2CH2OH
dHOCH2CH2NH2
正确答案
见解析。
解析
(1)2△H2—△H1
(2)①<
②T1-T2区间,化学反应未达到平衡,温度越高,反应速率越快,所以CO2被捕获的量随温度的升而提高。T4- T5区间,化学反应已到达平衡,由于正反应是放热反应,温度升高,平衡向逆反应方向移动,所以不利于CO2的捕获。
③
(3)降低温度;增加CO2浓度(或压强)
(4)BD
知识点
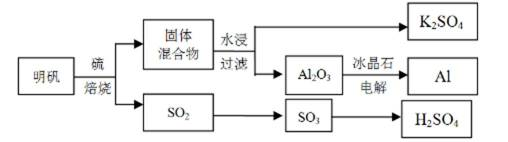
明矾石经处理后得到明矾[ KAl(SO4)2·12H2O]。从明矾制备Al、K2SO4和H2SO4的工艺过程如下所示:
焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4 +2Al2O3+9SO2+48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,还原剂是 。
(2)从水浸后的滤液中得到K2SO4晶体的方法是 。
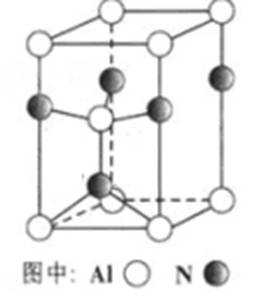
(3)A12O3在一定条件下可制得AIN,其晶体结构如右图所示,该晶体中Al的配位数是
(4)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是 。
(5)焙烧产生的SO2可用于制硫酸。已知25℃、101 kPa时:
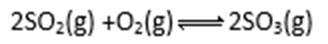
2H2O (g)=2H2O(1)
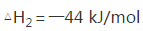
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)
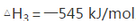
则SO3 (g)与H2O(l)反应的热化学方程式是 。
焙烧948t明矾(M=474 g/mol ),若SO2 的利用率为96%,可生产质量分数为98%的硫酸 t。
正确答案
(1)S
(2)蒸发结晶
(3)4
(4)Al+3NiO(OH)+H2O==NaAlO2+3Ni(OH)2
(5)SO3(g)+H2O(l)==H2SO4(l), ΔH=-130 KJ/mol
432t
解析
(5)ΔH=(ΔH3-ΔH1-2ΔH2)/2=-130 KJ/mol
948 t明矾生成SO2物质的量为4500mol
故生成硫酸的质量m=4500×0.96×98÷0.98=432000Kg=432t.
知识点
在1200℃时,天然气脱硫工艺中会发生下列反应
则△ H4的正确表达式为
正确答案
解析
考察盖斯定律。根据S守恒原理,要得到方程式4,可以用(方程式1+方程式2—3×方程式2)×
知识点
磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物在工农业生产中有着重要的应用。
(1)白磷(P4)可由Ca3(PO4)2、焦炭和SiO2 在一定条件下反应获得。相关热化学方程式如下:
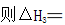
(2)白磷中毒后可用CuSO4溶液解毒,解毒原理可用下列化学方程式表示:
60mol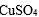
(3)磷的重要化合物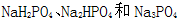
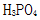
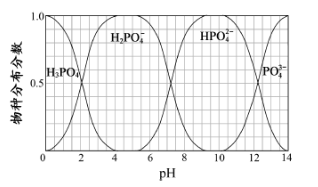
①为获得尽可能纯的NaH2PO4,pH应控制在 ;pH=8时,溶液中主要含磷物种浓度大小关系为 。
②Na2HPO4 溶液显碱性,若向溶液中加入足量的CaCl2 溶液,溶液则显酸性,其原因是
(用离子方程式表示)。
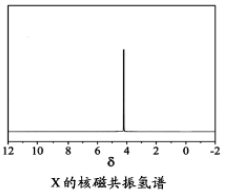
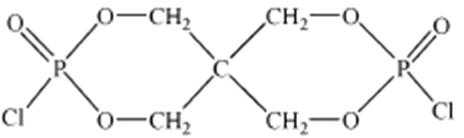
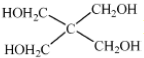
(4)磷的化合物三氯氧磷(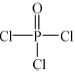
①酸性气体是 (填化学式)。
②X的结构简式为 。
正确答案
解析
(1)2821. 6
(2)3 mol
(3)①4 ~5. 5(介于此区间内的任意值或区间均可) c(HPO42-)>c(H2PO4-)
②3Ca2++2HPO42-=== Ca3(PO4)2↓+2H+
(4)①HCl
②
知识点
扫码查看完整答案与解析