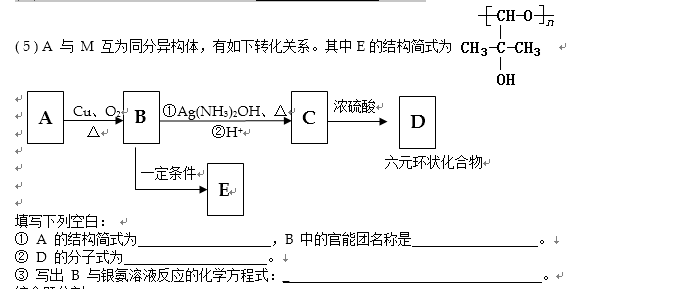
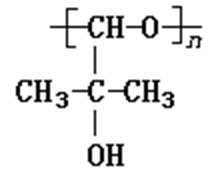
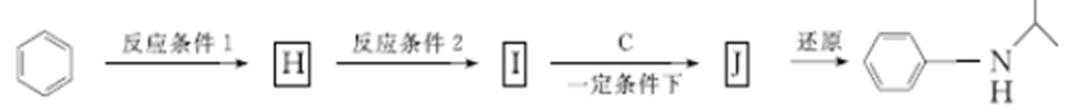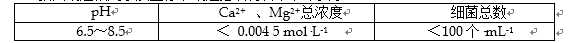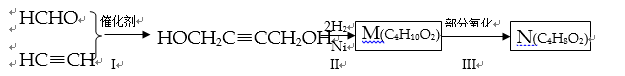- 常见有机物及其应用
- 共1422题
18.请考生在第18、19、20三题中任选一题作答,如果多做,则按所做的第一题计分.)
[选修5—有机化学基础]
18—Ⅰ(6分)下列有机物的命名错误的是
18—Ⅱ(14分)芳香族化合物A可进行如下转化:
回答下列问题:
(1)B的化学名称为 。
(2)由C合成涤纶的化学方程式为 。
(3)E的苯环上一氯代物仅有两种,E的结构简式为 。
(4)写出A所有可能的结构简式 。
(5)写出符合下列条件的E的同分异构体的结构简式 。
①核磁共振氢谱显示苯环上仅有两种氢②可发生银镜反应和水解反应
[选修3—物质结构与性质]
19—Ⅰ(6分)下列物质的结构或性质与氢键无关的是
A.乙醚的沸点 B.乙醇在水中的溶解度
C.氢化镁的晶格能 D.DNA的双螺旋结构
19—Ⅱ(14分)钒(23V)是我国的丰产元素,广泛用于催化及钢铁工业。
回答下列问题:
(1)钒在元素周期表中的位置为 ,其价层电子排布图为 。
(2)钒的某种氧化物的晶胞结构如图1所示。晶胞中实际拥有的阴、阳离子个数分别为 、 。
(3)V2O5常用作SO2 转化为SO3的催化剂。SO2 分子中S原子价层电子对数是 对,分子的立体构型为 ;SO3气态为单分子,该分子中S原子的杂化轨道类型为 ;SO3的三聚体环状结构如图2所示,该结构中S原子的杂化轨道类型为 ;该结构中S—O键长由两类,一类键长约140pm,另一类键长约为160pm,较短的键为 (填图2中字母),该分子中含有 个
(4)V2O5 溶解在NaOH溶液中,可得到钒酸钠(Na3VO4),该盐阴离子的立体构型为 ;也可以得到偏钒酸钠,其阴离子呈如图3所示的无限链状结构,则偏钒酸钠的化学式为 。
[选修2—化学与技术]
20—Ⅰ(6分)下列有关海水综合利用的说法正确的是
A.电解饱和食盐水可制得金属钠 B.海带提碘只涉及物理变化
C.海水提溴涉及到氧化还原反应 D.海水提镁涉及到复分解反应
20—Ⅱ(14分)
铁在自然界分别广泛,在工业.农业和国防科技中有重要应用。
回答下列问题:
(1)用铁矿石(赤铁矿)冶炼生铁的高炉如图(a)所示。原料中除铁矿石和焦炭外含有 。除去铁矿石中脉石(主要成分为SiO2 )的化学反应方程式为 、 ;高炉排出气体的主要成分有N2、CO2 和 (填化学式)。
(2)已知:①Fe2O3 (s)+3C(s)=2Fe(s)+3CO(g) ΔH=+494kJ•mol-1
②CO(g)+ O2(g)=CO2(g) ΔH=-283kJ•mol-1
③C(s)+ O2(g)=CO(g) ΔH=-110kJ•mol-1
则反应Fe2O3 (s)+3 C(s)+ O2(g)=2Fe(s)+3CO2 (g) 的ΔH= kJ•mol-1。理论上反应 放出的热量足以供给反应 所需的热量(填上述方程式序号)
(3)有人设计出“二步熔融还原法”炼铁工艺,其流程如图(b)所示,其中,还原竖炉相当于高炉的 部分,主要反应的化学方程式为 ;熔融造气炉相当于高炉的 部分。
(4)铁矿石中常含有硫,使高炉气中混有SO2 污染空气,脱SO2 的方法是 。
正确答案
18—ⅠBC;
18—Ⅱ(1)醋酸钠。
(2)略。
(3)HO—
(4)略。
(5)HCOO—
19-I AC
19-II
(1)第四周期、VB族 
(2)4 2 (每空1分,共2分)
(3)3 V形 SP2 SP3 a 12 (每空1分,共6分)
(4)正四面体 NaVO3 (1分,2分,共3分)
20- I CD (6分)
20-II
(1)石灰石 CaCO3

(2分,1分,1分,1分,共5分)
(2)-355 ②③,① (2分,2分,1分,共5分)
(3)炉身 Fe2O3 + 3CO
(4)将高炉气通过石灰乳 (1分)
知识点
7.下列有关说法正确的是
正确答案
解析
A.2,2-二甲基丁烷的一氯代物种类数为3,2,4-二甲基戊烷的一氯代物种类数为3,A正确;B.乙烷、苯不能使酸性高锰酸钾溶液褪色,裂化汽油含有不饱和键,能使高锰酸钾酸性溶液褪色,B错误; C.苯的密度比水小,但由苯反应制得的溴苯、硝基苯的密度比水大,环已烷的密度比水小,C错误;D.皂化反应是油脂与氢氧化钠或氢氧化钾混合,得到高级脂肪酸的钠/钾盐和甘油的反应,D错误; 故选A。
考查方向
解题思路
A.2,2-二甲基丁烷的一氯代物种类数为3,2,4-二甲基戊烷的一氯代物种类数为3;B.乙烷、苯不能使酸性高锰酸钾溶液褪色,裂化汽油含有不饱和键,能使高锰酸钾酸性溶液褪色; C.由苯反应制得的溴苯、硝基苯的密度比水大,环已烷的密度比水小;D.皂化反应是油脂与氢氧化钠或氢氧化钾混合,得到高级脂肪酸的钠/钾盐和甘油的反应;
易错点
理解皂化反应的定义。
知识点
4.X、Y、Z、W、M五种短周期元素的原子序数依次增大,X原子的电子层数等于其电子总数,Z原子最外层电子数与X、Y原子最外层电子数之和相等,W原子和Y原子最外层电子数之和为Z原子最外层电子数的2倍,W原子的最外层电子数为电子层数的3倍,X、M同主族。下列说法正确的是()
正确答案
解析
A.原子半径大小顺
B.H、C、N、O四种元素都属于非金属元素,NH4Cl属于离子化合物。
C.C、N、O、Na四种元素与H元素分别形成的最简单化合物的沸点不是依次升高
D.H、Na均可与O形成可用于自来水杀菌消毒的强氧化性化合物,过氧化氢和过氧化钠。
考查方向
解题思路
X、Y、Z、W、M五种短周期元素的原子序数依次增大,X原子的电子层数等于其电子总数,Z原子最外层电子数与X、Y原子最外层电子数之和相等,W原子和Y原子最外层电子数之和为Z原子最外层电子数的2倍,W原子的最外层电子数为电子层数的3倍,X、M同主族。X属于H;W是O;M是Na;Y是C;Z是N;
易错点
X、Y、Z、W、M五种短周期元素的推导。
知识点
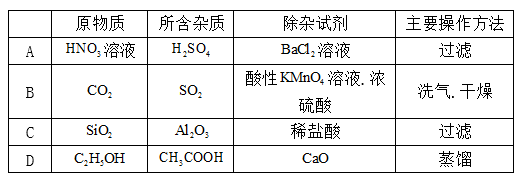
7.下列除杂试剂或方法有错误的是( )
正确答案
解析
A.硫酸与氯化钡反应生成硫酸钡和盐酸,引入新杂质,故A错误;
B.二氧化硫与高锰酸钾发生反应,而二氧化碳不能,则利用酸性KMnO4溶液.浓硫酸试剂洗气. 干燥可除杂,故B正确;
C.氧化铝与盐酸反应,而二氧化硅不能,则加足量稀盐酸.过滤可除杂,故C正确;
D.乙酸与CaO反应后,增大与乙醇沸点差异,则加CaO后蒸馏可分离,故D正确;故选A。
考查方向
解题思路
硫酸与氯化钡反应生成硫酸钡和盐酸;二氧化硫与高锰酸钾发生反应,而二氧化碳不能;氧化铝与盐酸反应,而二氧化硅不能;乙酸与CaO反应后,增大与乙醇沸点差异。
易错点
对物质的分离,提纯不熟悉,没有把握物质的性质。发生的反应及混合物分离方法,缺乏侧重分析与应用的能力,没有掌握元素化合物知识的综合应用。
知识点
26.席夫碱类化合物G在催化、药物、新材料等方面有广泛应用。合成G的一种路线如下:
已知以下信息:
①
②1molB经上述反应可生成2molC,且C不能发生银镜反应。
③D属于单取代芳香烃,其相对分子质量为106。
④核磁共振氢谱显示F苯环上有两种化学环境的氢。
⑤
回答下列问题:
(1)由A生成B的化学方程式为___________________,反应类型为___________________。
(2)D的化学名称是 ___________________,由D生成E的化学方程式为: ___________________ 。
(3)G的结构简式为___________________。
(4)F的同分异构体中含有苯环的还有________种(不考虑立体异构)。其中核磁共振氢谱中有
4组峰,且面积比为6:2:2:1的是__________________。(写出其中的一种的结构简式)。
(5)由苯和化合物C经如下步骤可合成N-异丙基苯胺。
反应条件1所选择的试剂为_________________;反应条件2所选择的试剂为___________;I的结构简式为________________________。
正确答案
(1)C(CH3)2Cl—CH(CH3)2+NaOH乙醇△ C(CH3)2=C(CH3)2+NaCl+H2O,消去反应
(2)乙苯,C2H5—+HNO3
(3)C2H5——NCH3
(4)19种,
(5)浓硝酸、浓硫酸;Fe/稀盐酸;—NH2。
解析
解析已在路上飞奔,马上就到!
知识点
28.利胆解痉药“亮菌甲素”跟(CH3)2SO4反应可以生成A,二者的结构简式如下图。
试回答下列有关问题:
(1)(CH3)2SO4 属于_______ 类(选填:醇、醚、酸、酯、盐);“亮菌甲素”不能发生的反应有_______ 。
A.加成反应 B.取代反应
C.缩聚反应 D.消去反应
E.还原反应
(2)有机物A能发生如下转化.其中G分子中的碳原子在一条直线上.
已知:(1)
(2)
①C→D的化学方程式是________________________;
②G的结构简式是_________;
③同时符合下列条件的E的同分异构体H有_________种:
a.遇FeCl3溶液显色;
b.不能发生水解反应,能发生银镜反应;
c.苯环上的一氯取代物只有一种,分子中无甲基
写出其中2种的结构简式:___________________________.
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
11.化合物III可通过如下反应制得:
化合物I可通过下列路径合成:
①化合物I的分子式为__________________。化合物Ⅱ中含氧官能团的名称_________。
②化合物III与NaOH溶液共热反应的方程式__________________。
③化合物IV的结构简式为_________,生成化合物IV的反应类型为_________。
④化合物I 能发生消去反应,其中一种有机产物的结构简式_________。
⑤一定条件下,1 mol化合物Ⅱ和H2反应,最多可消耗H2_________ mol。
⑥CH3CH2MgBr和
正确答案
⑴C10H14O,羧基
⑵
⑶ 
⑷ 

⑸ 1
⑹
解析
解析已在路上飞奔,马上就到!
知识点
请考生从给出的3道物理题、3道化学题、2道生物题中每科任选一题做答。
36.【化学——选修2化学与技术】
(1)下列关于工业生产说法正确的是 ( ) 。(填序号)
A.在侯氏制碱工业中,向饱和氯化钠溶液中先通二氧化碳,后通氨气
B.在硫酸工业、合成氨工业、硝酸工业中,皆采用循环操作提高原料利用率
C.在氯碱工业,电解槽被离子交换膜隔成阴极室和阳极室
D.工业上采用电解熔融氯化铝的方法制取金属铝
E.石油裂化属于化学变化,主要目的是为了获得短链不饱和气态烃
(2)我国规定饮用水质量标准规定必须符合下表中要求:
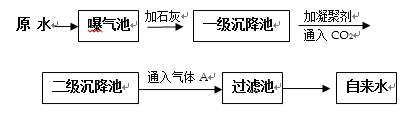
以下是原水处理成自来水的工艺流程示意图:
①原水中含Ca2+ 、Mg2+ 、HCO3-、Cl-等,加入石灰生成Ca(OH)2,进而发生若干复分解反应,写出其中的离子方程式(只要求写出两个):( ); ( )。
②FeSO4·7H2O是常用的凝聚剂,它在水中最终生成 ( ) 沉淀;通入二氧化碳的目的是 ( ) 和 ( ) 。
③气体A的作用是( ),下列物质中( ) 可以作为气体A的代用品(填编号)。a.ClO2 b.浓氨水 c.K2FeO4 d.SO2 e.漂白粉
37.【化学——选修3物质结构与性质】A、B、C、D、E、F、G是原子序数依次增大的七种元素,其中A、B、C、D、E为短周期元素, F、G为第四周期元素。已知:A是原子半径最小的元素,B、C、D是紧邻的三个族的元素,C的三价阴离子和E的二价阳离子具有相同的电子层结构,F元素的基态原子具有六个成单电子,G是ⅠB族的元素。回答下列问题:(1) 写出E、F、G的元素符号 ( ) ,B、C、D元素的第一电离能由大到小的顺序是 ( ) (用元素符号表示),A元素分别与B、D元素形成的二种微粒都具有NH3相似的结构,属于等电子体,它们的化学式是 ( ) 。(2) F元素的原子基态价层电子排布图是 ( ) 。
⑶向G的硫酸盐溶液中滴加氨水会生成蓝色沉淀,继续滴加氨水至沉淀刚好全部溶解时可得到蓝色溶液,继续向其中加入极性较小的乙醇可以生成深蓝色的[G(NH3)4]SO4·H2O沉淀。该深蓝色沉淀中的NH3通过________键与中心离子G2+结合;NH3分子中N原子的杂化方式是________;
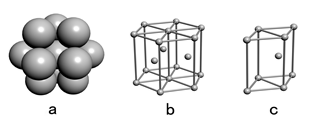
(4)E单质晶体中原子的堆积模型如右图,晶胞是图中的( )
(填a、b或c);配位数是( );若紧邻的四个E原子的中心连线构成的几何体的体积是a cm3,E单质的密度为ρg/ cm3;则E的相对原子质量的计算式是 ( ) 。
38.【化学——选修5有机化学基础】
以 HCHO 和 C2H2为有机原料,经过下列反应可得化合物 N ( C4H8O2)。
( l )反应Ⅰ的反应类型为 ( ) 。 ( 2 ) HOCH2C≡CCH2OH 分子中,在同一个平面的原子最多有 ( ) 个。 ( 3)化合物 M 不可能发生的反应是 ( ) (填序号)。 A.氧化反应 B.取代反应 C.消去反应 D.加成反应 E.还原反应 ( 4 ) N 的同分异构体中,属于酯类的有 ( )种。
36.(15分)【化学——选修2化学与技术】
(1)下列关于工业生产说法正确的是 。(填序号)
37.(15分)【化学——选修3物质结构与性质】
正确答案
正确答案
请考生从给出的3道物理题、3道化学题、2道生物题中每科任选一题做答。
36.(15分)[化学选修一化学与技术]
工业生产Na2S常用方法是:无水芒硝(Na2SO4)一碳还原法,其流程示意图如下:
(1)若煅烧阶段所得气体为等物质的量CO和CO2。写出煅烧时发生的总反应方程式:
;
(2)用碱液浸出产品比用热水更好,理由是: ;
(3)废水中汞常用硫化钠除去,汞的除去率与溶液pH和硫化钠实际用量与理论用量比值X的关系如右图所示。为使除汞达到最佳效果,应控制条件是 。
(4)取Na2S(含少量NaOH),加人到CuSO4溶液中,充分搅拌,若反应后溶液pH=4,此时溶液中c(S 2-)= ;(保留2位有效数字)(已知:CuS Ksp=8.8×10-36;Cu(OH)2 Ksp=2.2×10-20)
(5)纳米Cu2O常用电解法制备,制备过程用铜棒和石墨棒作电极,Cu(NO3)2作电解液。电解生成Cu2O应在 ;该电极pH将 (填“升高”,“不变”或“降低”),用电极方程式解释pH发生变化的原因: 。37.(15分)(化学选修一物质结构与性质]

有机物A、B、C、D、E、F、G有一个相同官能团,它们之间有下图转化关系:
已知:
①A的相对分子质量比B大2;②RCH2OH
根据以上信息回答下列问题:
(1)各物质均含有官能团的名称是 ;化合物G的结构简式为 ;
(2)实现A—E转化的反应类型是 ;实现E→F转化的一定条件是 ;
(3)化合物B在Ni催化条件能与H2发生加成,理论上1mol B最多可能消耗H2的物质的量为 ;
(4)写出B与银氨溶液反应的方程式: ;
(5)写出同时满足下列三个条件的F同分异构体共有 种;写出其中一种的结构简式: 。(不包括立体异构)
a.苯环上只有一个侧链 b.属于酯类化合物 c.含一个碳碳双键
正确答案
正确答案
请考生从给出的3道物理题、3道化学题、2道生物题中每科任选一题做答。
36.由铝土矿(主要成分是Al2O3)炼制铝的工艺流程示意图如下:
(1)电解生成的铝在熔融液的______ (填“上层”或“下层”),电解时不断消耗的电极是______ (填“阴极”或“阳极”)。
(2)写出通入过量二氧化碳酸化时反应的离子方程式______。
(3)电解制备锅时,需加入冰晶石(Na3AlF6),其作用是______,工业上可以用氟化氢气体、氢氧化铝和纯碱在高温条件下发生反应来制取冰晶石,写出 该反应的化学方程式______

(5)对金属制品进行抗腐蚀处理,可延长其使用寿命。
①控制一定条件进行电解(见右图),此时铝表面可形成 耐酸的致密氧化膜,其电极反应式为______;
②钢材镀铝后,能防止钢材腐蚀,其原因是______37. VA族的氮、磷、砷(As)、锑(Sb)等元素在化合物中常表现出多种氧化态,含VA 族元素的化合物在科研和生产中有许多重要用途。请回答下列问题:
(1)N、P、As原子的第一电离能由大到小的顺序为______ (用元素符号表示)。
(2)As原子核外M层电子的排布式为______。

(4)白磷(P4)的结构如右图所示,P原子的轨道杂化方式是______ 。
(5)NO2-可以与许多金属离子形成配合物,例如[Co(NO2)6]3-,它可以用来检验K+, 其反应如下:
①NO2-的立体构型是______;
②在
(6)天然氨基酸的命名常用俗名(根据来源与性质),例如,最初从蚕丝中得到的氨基酸叫 丝氨酸(


①醛(或酮)在NaOH溶液中与HCN反应,可引入腈基(一CN),棱碳链增长。
如:
②腈在酸性条件下水解生成羧酸。
如:
回答下列问题:
(1)C2H4的某种二氯取代物C1CH=CHC1是否存在顺反异构?______(填“是”或“否”)。
(2)反应⑥投料时,通常使B原料过量,其目的是______; B的质谱图中,某碎片离子的质荷比为31,该碎片离子所含碳、氢、氧原子数之比为______。
(3)反应①〜⑥中,属于加成反应的是—(填写反应编号),D的结构简式是______
(4)写出反应⑤的化学方程式__________________
(5)E在催化条件下可聚合成一种易降解的高分子化合物,写出该聚合反应的化学方程 式____________
(6)B与E酯化或丙酮酸乙酯与氢气加成,均可生成有机物G (C5Hi0O3)。G的同分异构体中能发生银镜反应和水解反应,还能与金属钠反应生成氢气的共有______种(不考虑立体异构),其中核磁共振氢谱有四种不同化学环境氢原子的异构体是______ (写出其中一种的结构简式)。
正确答案
已知:CH2=CH-CH=CH2+R-CH=CH-R´
A 、B、C、D、E、F分别表示一种有机物,E的相对分子质量为278,其转化关系如下图所示(其他反应产物及反应条件略去):
请回答下列问题:
(1) 
(2)A反应生成B需要的无机试剂是___________。上图所示反应中属于加成反应的共有______________个。
(3)B与O2反应生成C的化学方程式为____________。
(4)F的结构简式为____________。
(5)写出含有HC≡C-、氧原子不与碳碳双键和碳碳三键直接相连、呈链状结构的C物质的所有同分异构体的结构简式:_____________。
正确答案
(1)醛基
(2)NaOH的水溶液 3
(3)CH2OHCH=CHCH2OH+O2
(4)
(5)HC≡C-CH(OH)CHO、HC≡C-
解析
根据流程图和所给信息可知A为:CH2BrCH=CHCH2Br,B为CH2OHCH=CHCH2OH,C为OHCCH=CHCHO,D为


(1) 
(2)强碱KOH或NaOH的水溶液CH2=CH-CH=CH2与溴反应生成A,属于加成反应;CH2=CH-CH=CH2和C生成

(3)B为CH2OHCH=CHCH2OH与O2反应的方程式为:CH2OHCH=CHCH2OH+O2
(4)F的结构简式为:
(5)C为OHCCH=CHCHO,符合条件的同分异构体有:HC≡C-CH(OH)CHO、HC≡C-
知识点
红辣椒中含有多种色泽鲜艳的天然色素,其中呈深红色的色素是辣椒红,依据下列结构式判断,辣椒红
正确答案
解析
辣椒红分子结构为长链有机分子,应为弱极性分子,一般难溶液于水;在其分子结构中不含苯环,不属于芳香族化合物;其分子结构中含量有羟基,能能发生消除反应;其分子中分子中含有10个碳碳双键。
知识点
下列说法不正确的是
正确答案
解析
A选项,一分子麦芽糖由两分子葡萄糖缩合生成,因此麦芽糖与水解产物葡萄糖均可以发生银镜反应;B选项,苯酚与溴水反应生成白色沉淀三溴苯酚,与2、4-己二烯发生加成反应褪色,与甲苯不发生反应但会发生萃取分层的现象;C选项,酸性条件下,CH3CO18OC2H5水解生成CH3COOH与C2H518OH;D选项,生成的二肽有四种,分别是


知识点
某天然拒食素具有防御非洲大群蚯蚓的作用,其结构简式如题5图(未表示出原子或原子团的空间排列)。该拒食素与下列某试剂充分反应,所得有机物分子的官能团数目增加,则该试剂是( )
正确答案
解析
略
知识点
下图表示4—溴环己烯所发生的4个不同反应。其中,产物只含有一种官能团的反应是
正确答案
解析
易知发生四个反应得到的产物如下图所示,显然Y、Z中只含一种官能团,即可
知识点
扫码查看完整答案与解析