- 常见有机物及其应用
- 共1422题
8.某羧酸酯的分子式为C57H104O6,1mol该酯完全水解可得到1mol甘油
[HOCH2CH(OH)CH2OH]和3mol羧酸。该羧酸的分子式为
正确答案
解析
有机化学的化学式及化学方程式无法复制黏贴上去,要一个一个上传,能否直接粘贴上去
考查方向
考查有机物的合成与推断、官能团的结构与性质、有机反应类型、限制条件同分异构体书写
解题思路
(1)由D的结构简式可知,含有的含氧官能团为羧基、醚键;对比B、C结构可知,B与对甲基苯酚发生酯化反应,属于取代反应,甲基间位的C-H键断裂与碳碳双键发生加成反应形成六元环;
(2)由信息可知,对比苯甲醛与乙醛反应得到A为
(3)苯甲醛与银氨溶液反应氧化反应得到苯甲酸铵、Ag、氨气与水,反应方程式为

(4)B的一种同分异构体满足下列条件:①能使溴的CCl4溶液褪色,说明含有不饱和键,可以是碳碳
易错点
有机化学的化学式及化学方程式无法复制黏贴上去,要一个一个上传,能否直接粘贴上去
教师点评
有机化学的化学式及化学方程式无法复制黏贴上去,要一个一个上传,能否直接粘贴上去
知识点
14、部分氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共5.76g,经如下处理:
下列说法正确的是( )
正确答案
解析
:A.滤液A中加入足量氢氧化钠溶液,所得滤渣灼烧得到的固体3.2g为Fe2O3,其物质的量=3.2g/160g/mol=0.02mol,铁元素的物质的量为0.04mol,滤液A中溶质为过量H2SO4和FeSO4,说明参加反应硫酸物质的量为0.04mol,含氢离子0.08mol,其中部分氢离子生成氢气,另外的H+和合金中的氧结合成水了,合金中Fe元素质量=0.04mol×56g/mol=2.24g,故合金中氧原子的物质的量5.76g−3.2g−2.24g/16g/mol=0.02mol,它结合氢离子0.04mol,所以硫酸中有0.08mol-0.04mol=0.04mol H+生成氢气,即生成0.02mol氢气,标况体积=0.02mol×22.4L/mol=0.448L=448mL,故A错误;
B.合金中Fe元素的质量为:56g/mol×0.04mol=2.24g,故合金中Fe元素质量分数=2.24g/5.76g×100%=38.89%,故B正确;C.由于氧化性Fe3+>Cu2+>H+,铁离子优先反应,由于滤液A中不含铜离子,且硫酸足量,滤液A中阳离子为:Fe2+、H+,故C错误
D.由于硫酸过量,生成氢气,滤液中不含铜离子,滤渣3.2g为金属铜,铜元素的物质的量为3.2g/64g/mol=0.05mol,若全部为氧化铜,氧化铜的质量为:80g/mol×0.05mol=4.0g,由于部分铜被氧化成氧化铜,则样品中氧化铜的质量一定小于4.0g,故D错误;
考查方向
解题思路
A.滤液A中加入足量氢氧化钠溶液,所得滤渣灼烧得到的固体3.2g为Fe2O3,物质的量为0.02mol,铁元素的物质的量为0.04mol,滤液A溶质为过量H2SO4和FeSO4,而铁元素物质的量为0.04mol,说明参加反应硫酸物质的量为0.04mol,硫酸含氢离子0.08mol,其中部分氢离子生成氢气,另外的H+和合金中的氧结合成水了,计算合金中氧元素的质量,进而计算合金中氧原子的物质的量,计算氧原子结合氢离子物质的量,再根据H原子守恒生成氢气的体积;B.结合A根据质量分数定义计算Fe元素质量分数;
C.硫酸足量,氧化性:Fe3+>Cu2+>H+,铁离子优先反应,由于滤液A中不含铜离子,且有气体氢气生成,则滤液A中不含铁离子;D.滤渣3.2g为金属铜,物质的量为0.05mol,即合金样品中总共含有铜元素0.05mol,利用极限法判断样品中CuO的质量问题.
易错点
注意利用极限法与原子守恒解答
知识点
1.化学
正确答案
解析
A、塑料、人造纤维和合成橡胶都属于有机高分子化合物。
B、硅胶具有吸水性、铁粉可与氧气反应,可防止食物受潮、氧化变质。
C、Fe(OH)3具有吸附性,可以作为饮用水的消毒剂。
D、草木灰的主要成分是碳酸钾,反应式书写错误。
考查方向
解题思路
A、塑料、人造纤维和合成橡胶都属于有机高分子化合物。
B、硅胶具有吸水性、铁粉可与氧气反应。
C、Fe(OH)3具有吸附性
D、草木灰的主要成分是碳酸钾。
易错点
Fe(OH)3具有吸附性可以作为饮用水的消毒剂和净化剂。
知识点
5.下列实验操作、现象和得出的结论均正确的是()
正确答案
B
解析
A、高锰酸钾可以氧化亚铁离子成三价铁离子,无法判定是否是三价还是二价铁。
B、溶解度越小越生成沉淀。
C、蓝色钴玻璃可以滤掉黄色的火焰,还可能含有钠。
D、未能证明该反应在碱性环境中,可能是酸和碱完全反应了。
考查方向
本题主要考查了实验综合。
解题思路
A、高锰酸钾可以氧化亚铁离子成三价铁离子。
B、溶解度越小越生成沉淀。
C、蓝色钴玻璃可以滤掉黄色的火焰。
D、未能证明该反应在碱性环境中。
易错点
实验综合。
知识点
有机化合物甲、乙用于制备化妆品,二者合成路线如下(部分产物及条件略)。
已知:
(-R、-R’代表烃基或-H)
13.D的结构简式是 。
14.化合物A能与浓溴水反应产生白色沉淀。
①“E→F”的反应类型是 。
②“F→有机化合物甲”的化学方程式是 。
③ 化合物A的结构简式是 。
15.化合物C的分子式为C3H6O,核磁共振氢谱显示只有一种化学环境的氢。
C的结构简式是 。
16.化合物W的相对分子质量为106, 关于B与W的说法,正确的是 。
a. 互为同系物
b. 可以用酸性KMnO4溶液鉴别
c. 相同物质的量的B和W与H2完全反应,消耗H2物质的量不同
17.M、N中均只含一种官能团,N中含有四个甲基。
① X的结构简式是 。
② 满足合成路线的N的同分异构体是 。
正确答案
(1)CH≡CH (2 分)
解析
D的结构简式是CH≡CH,故答案为:CH≡CH;
考查方向
有机物的合成
解题思路
碳化钙与水反应生成A为CH≡CH,乙炔与氢气发生加成反应生成乙烯,由甲的结构,逆推可知F为







易错点
本题由甲与乙的结构、结合问题中物质的结构特点进行推断时,容易理解错题目给予的反应信息。
正确答案
(2) ① 加成反应 (2 分)
②
③ 
解析
)①“E→F”的反应类型是:加成反应,故答案为:加成反应;
②“F→有机化合物甲”的化学方程式是:
故答案为:
③化合物A的结构简式是:

考查方向
有机物的合成
解题思路
碳化钙与水反应生成A为CH≡CH,乙炔与氢气发生加成反应生成乙烯,由甲的结构,逆推可知F为







易错点
本题由甲与乙的结构、结合问题中物质的结构特点进行推断时,容易理解错题目给予的反应信息。
正确答案
(3) 
解析
化合物C的分子式为C3H6O,核磁共振氢谱显示只有一种化学环境的氢.C的结构简式是:
故答案为:
考查方向
有机物的合成
解题思路
碳化钙与水反应生成A为CH≡CH,乙炔与氢气发生加成反应生成乙烯,由甲的结构,逆推可知F为







易错点
本题由甲与乙的结构、结合问题中物质的结构特点进行推断时,容易理解错题目给予的反应信息。
正确答案
(4)a b (2 分)
解析
W为

a.二者互为同系物,故a正确;
b.乙苯能使酸性KMnO4溶液褪色,而苯不能,可以鉴别,故b正确;
c.相同物质的量的B和W与H2完全反应,消耗H2物质的量相同,故c错误,
故选:ab;
考查方向
有机物的合成
解题思路
碳化钙与水反应生成A为CH≡CH,乙炔与氢气发生加成反应生成乙烯,由甲的结构,逆推可知F为







易错点
本题由甲与乙的结构、结合问题中物质的结构特点进行推断时,容易理解错题目给予的反应信息。
正确答案

CH3

(共3分,写出1个2 分,2个全对3分)
解析
①由上述分析可知,X的结构简式是:

②满足合成路线的N的同分异构体是
故答案为:
考查方向
有机物的合成
解题思路
碳化钙与水反应生成A为CH≡CH,乙炔与氢气发生加成反应生成乙烯,由甲的结构,逆推可知F为







易错点
本题由甲与乙的结构、结合问题中物质的结构特点进行推断时,容易理解错题目给予的反应信息。
3.H2S利用是回收能量并得到单质硫。反应原理为:2H2S(g)+02(g)=S2(s)+2H20(1)
ΔH=-632kJ·mol-1。下图为质子膜H2S燃料电池示意图。下列说法正确的是( )
正确答案
解析
A、原电池是把化学能转化为电能的装置,但是化学能不能全部转化为电能,有部分化学能转化为热能等其它形式的能量,故A错误;B、正极O2得电子发生还原反应,酸性条件下,氧气得电子生成水,则电极b上发生的电极反应为:O2+4H++4e-=2H2O,故B错误;C、a极为负极,负极上硫化氢失电子生成S2和氢离子,则电极a上发生的电极反应为:2H2S-4e-═S2+4H+,故C正确;D、标况下,当有22.4LH2S即1molH2S参与反应,则消耗0.5mol氧气,则根据O2+4H++4e-=2H2O,所以有2mol H+经质子膜进入正极区,故D错误;
故选:C.
。
考查方向
解题思路
“根据2H2S(g)+O2(g)═S2(s)+2H2O反应,得出负极H2S失电子发生氧化反应,正极O2得电子发生还原反应,溶液中阳离子向正极移动,据此分析解答.
易错点
原电池原理,明确电解质溶液酸碱性
知识点
选做题:请从32、33两题中任选一题
32.【化学——物质的结构】
在元素周期表中,除稀有气体外几乎所有元素都能与氢形成氢化物。氢化物晶体的结构有共价型和离子型之分。
(1)氨气是共价型氢化物。工业常用氨气和醋酸二氨合铜{[Cu(NH3)2]Ac}的混合液来吸收一氧化碳(醋酸根CH3COO简写为Ac)。反应方程式为:[Cu(NH3)2]Ac+ CO+NH3
①请写出基态Cu原子的电子排布式__________。
②氨水溶液中各元素原子的电负性从大到小排列顺序为__________。
③醋酸分子中的两个碳原子,甲基(—CH3)碳和羧基(—COOH)碳的杂化方式分别是__________。
④生成物[Cu(NH3)3CO]Ac中所含化学键类型有__________。
a.离子键 b. 配位键
c. σ键 d. π键
(2)某离子型氢化物化学式为XY2,晶胞结构如下图所示,其中6个Y原子(○)用阿拉伯数字1~6标注。
①已知1、2、3、4号Y原子在晶胞上、下面上。则5、6号Y原子均在晶胞__________。(填“侧面”或“内部”)
②XY2晶体、硅烷晶体和固态氨3种氢化物熔沸点高低顺序正确的是__________。
a.XY2晶体>硅烷晶体>固态氨
b.XY2晶体>固态氨>硅烷晶体
c.固态氨>硅烷晶体>XY2晶体
d.硅烷晶体>固态氨>XY2晶体
33.【化学——有机化学】
合成某药物的流程“片段”如下:
已知:
请回答下列问题:
(1)A的名称是__________。
(2)反应②的化学方程式__________。
(3)B的结构简式为__________。
(4)X是
(5)某同学补充A到B的流程如下:
①A→T,如果条件控制不好,可能生成副产物,写出一种副产物的结构简式__________。
②若步骤II和III互换,后果可能是__________.
正确答案
33.【化学——物质的结构】
(1)
① [Ar]3d104s1
②O > N >H
③sp3;sp2
④abcd
(2)
① 内部;
②b
34.【化学——有机化学】
(1)甲苯
(2)
(3)
(4)3
(5)
①
②氨基被氧化(产品含杂质多,产率低)
解析
解析已在路上飞奔,马上就到!
知识点
20.在常温下,0.1000mol·L-1Na2CO3溶液25mL 用0.1000mol·L-1盐酸滴定,其滴定曲线如图。对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
以乙炔为原料在不同条件下可以合成多种有机物。
已知:
完成下列填空:
8.B 中官能团名称 ▲ ;④的反应类型 ▲ 。
9.⑤的反应条件 ▲ 。
10.③的化学方程式 ▲ 。
11.D 的同分异构体中含碳碳双键、能发生银镜反应且属于酯的共有 ▲ 种。
正确答案
(1)醛基 加成反应
解析
根据题中各物质转化关系,A与水发生加成反应和信息①得B为CH3CHO,B氧化得C为CH3COOH,根据D的分子式可知,A与C发生加成反应得D为CH3COOCH=CH2,D发生加聚反应得E为

(1)根据上面的分析可知,B为CH3CHO,反应④为加成反应,反应⑤的反应条件为铁粉作催化剂,故答案为:醛基;加成反应
考查方向
解题思路
根据题中各物质转化关系,A与水发生加成反应和信息①得B为CH3CHO,B氧化得C为CH3COOH,根据D的分子式可知,A与C发生加成反应得D为CH3COOCH=CH2,D发生加聚反应得E为

易错点
1、再通过试题中提供的信息,判断有机物可能存在的官能团和性质。
2、最后综合各种信息,关键根据原料和最终产物推断出各有机物的结构简式。
正确答案
(2)铁粉或氯化铁作催化剂
解析
根据题中各物质转化关系,A与水发生加成反应和信息①得B为CH3CHO,B氧化得C为CH3COOH,根据D的分子式可知,A与C发生加成反应得D为CH3COOCH=CH2,D发生加聚反应得E为

考查方向
解题思路
根据题中各物质转化关系,A与水发生加成反应和信息①得B为CH3CHO,B氧化得C为CH3COOH,根据D的分子式可知,A与C发生加成反应得D为CH3COOCH=CH2,D发生加聚反应得E为

易错点
1、再通过试题中提供的信息,判断有机物可能存在的官能团和性质。
2、最后综合各种信息,关键根据原料和最终产物推断出各有机物的结构简式。
正确答案
(3)
解析
根据题中各物质转化关系,A与水发生加成反应和信息①得B为CH3CHO,B氧化得C为CH3COOH,根据D的分子式可知,A与C发生加成反应得D为CH3COOCH=CH2,D发生加聚反应得E为

考查方向
解题思路
根据题中各物质转化关系,A与水发生加成反应和信息①得B为CH3CHO,B氧化得C为CH3COOH,根据D的分子式可知,A与C发生加成反应得D为CH3COOCH=CH2,D发生加聚反应得E为

易错点
1、再通过试题中提供的信息,判断有机物可能存在的官能团和性质。
2、最后综合各种信息,关键根据原料和最终产物推断出各有机物的结构简式。
正确答案
(4)3
解析
根据题中各物质转化关系,A与水发生加成反应和信息①得B为CH3CHO,B氧化得C为CH3COOH,根据D的分子式可知,A与C发生加成反应得D为CH3COOCH=CH2,D发生加聚反应得E为

故答案为:HCOOCH2CH=CH2、HCOOCH=CHCH3、HCOOC(CH3)C=CH2 故答案为3种。
考查方向
解题思路
根据题中各物质转化关系,A与水发生加成反应和信息①得B为CH3CHO,B氧化得C为CH3COOH,根据D的分子式可知,A与C发生加成反应得D为CH3COOCH=CH2,D发生加聚反应得E为

易错点
1、再通过试题中提供的信息,判断有机物可能存在的官能团和性质。
2、最后综合各种信息,关键根据原料和最终产物推断出各有机物的结构简式。
下列有关化学用语中正确的是
正确答案
解析
略
知识点
联苄(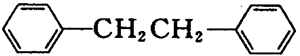
(一)催化剂的制备
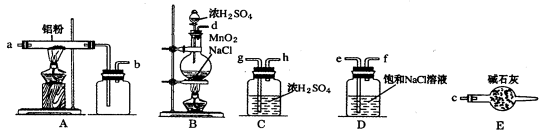
下图是实验室制取少量无水AlCl3的相关实验装置的仪器和药品:
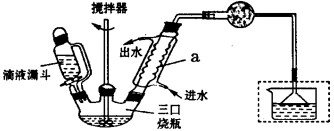
(二)联苄的制备
联苄的制取原理为:
反应最佳条件为n(苯) :n(1,2-二氯乙烷)=10 :1,反应温度在60-65℃之间。
实验室制取联苄的装置如下图所示(加热和加持仪器略去):
实验步骤:
在三口烧瓶中加入120.0
氯乙烷,控制反应温度在60-65℃,反应约60min。将反应后的混合物依次用稀盐酸、
2%Na2CO3溶液和H2O洗涤分离,在所得产物中加入少量无水MgSO4固体,静止、过
滤,先常压蒸馏,再减压蒸馏收集170~172℃的馏分,得联苄18.2 g。
相关物理常数和物理性质如下表
8.将上述仪器连接成一套制备并保存无水AlCl3的装置,各管口标号连接顺
9.有人建议将上述装
10.装置A中隐藏着一种安全隐患,请提出一种改进方案:_____________。
11.仪器a的名称为______________,和普通分液漏斗相比,使用滴液漏斗的优点是_
12.洗涤操作中,水洗的目的是_____________;无水硫酸镁的作用是______________。
13.常压蒸馏时,最低控制温度是________________。
14.该实验的产率约为______________。(小数点后保留两位有效数字)
正确答案
f,g,h,a,b,c
解析
【解析】将上述仪器连接成一套制备并保存无水AlCl3的装置,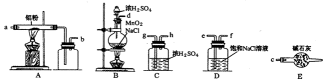
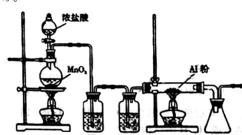

考查方向
解题思路
A装置用于Al和氯气反应,B用于产生氯气,C用于干燥气体,D用于除去HCl。E用于干燥,防止AlCl3遇水反应。Cl2中混有的HCl与Al反应生成H2,H2与Cl2混合加热时会发生爆炸。无水氯化铝遇到湿空气产生大量白雾。球形冷凝管和普通分液漏斗相比的优点是可以使液体顺利滴下。
易错点
无水氯化铝遇到湿空气产生大量白雾、制备实验方案的设计。
正确答案
可行,制得的Cl2中混有的HCl与Al反应生成H2,H2与Cl2混合加热时会发生爆炸。
解析
有人建议将上述装
考查方向
解题思路
A装置用于Al和氯气反应,B用于产生氯气,C用于干燥气体,D用于除去HCl。E用于干燥,防止AlCl3遇水反应。Cl2中混有的HCl与Al反应生成H2,H2与Cl2混合加热时会发生爆炸。无水氯化铝遇到湿空气产生大量白雾。球形冷凝管和普通分液漏斗相比的优点是可以使液体顺利滴下。
易错点
无水氯化铝遇到湿空气产生大量白雾、制备实验方案的设计。
正确答案
玻璃管与广口瓶之间用粗导管连接,防止AlCl3冷凝成固体造成堵塞。
解析
【解析】装置A中隐藏着一种安全隐患,无水氯化铝遇到湿空气产生大量白雾,白雾的成分是含结晶水的氯化铝固体,大量白雾会造成瞬间管道堵塞(正常情况下,管道是不堵塞的,因为是氯气携带气态无水氯化铝缓慢流过).因此,改用直接引入氯气的方法,例如灌装液氯.或在硬质玻璃管与广口瓶之间用粗导管连接,防止AlCl3冷凝成固体造成堵塞。
考查方向
解题思路
A装置用于Al和氯气反应,B用于产生氯气,C用于干燥气体,D用于除去HCl。E用于干燥,防止AlCl3遇水反应。Cl2中混有的HCl与Al反应生成H2,H2与Cl2混合加热时会发生爆炸。无水氯化铝遇到湿空气产生大量白雾。球形冷凝管和普通分液漏斗相比的优点是可以使液体顺利滴下。
易错点
无水氯化铝遇到湿空气产生大量白雾、制备实验方案的设计。
正确答案
球形冷凝管;可以使液体顺利滴下。
解析
仪器a的名称为球形冷凝管,和普通分液漏斗相比,使用滴液漏斗的优点是可以使液体顺利滴下。
考查方向
解题思路
A装置用于Al和氯气反应,B用于产生氯气,C用于干燥气体,D用于除去HCl。E用于干燥,防止AlCl3遇水反应。Cl2中混有的HCl与Al反应生成H2,H2与Cl2混合加热时会发生爆炸。无水氯化铝遇到湿空气产生大量白雾。球形冷凝管和普通分液漏斗相比的优点是可以使液体顺利滴下。
易错点
无水氯化铝遇到湿空气产生大量白雾、制备实验方案的设计。
正确答案
球形冷凝管;可以使液体顺利滴下。
解析
洗涤操作中,水洗的目的是洗掉Na2CO3(或洗掉可溶性无机物);无水硫酸镁的作用是吸水剂(干燥剂)。
考查方向
解题思路
A装置用于Al和氯气反应,B用于产生氯气,C用于干燥气体,D用于除去HCl。E用于干燥,防止AlCl3遇水反应。Cl2中混有的HCl与Al反应生成H2,H2与Cl2混合加热时会发生爆炸。无水氯化铝遇到湿空气产生大量白雾。球形冷凝管和普通分液漏斗相比的优点是可以使液体顺利滴下。
易错点
无水氯化铝遇到湿空气产生大量白雾、制备实验方案的设计。
正确答案
83.5℃
解析
常压蒸馏时,最低控制温度是83.5℃。
考查方向
解题思路
A装置用于Al和氯气反应,B用于产生氯气,C用于干燥气体,D用于除去HCl。E用于干燥,防止AlCl3遇水反应。Cl2中混有的HCl与Al反应生成H2,H2与Cl2混合加热时会发生爆炸。无水氯化铝遇到湿空气产生大量白雾。球形冷凝管和普通分液漏斗相比的优点是可以使液体顺利滴下。
易错点
无水氯化铝遇到湿空气产生大量白雾、制备实验方案的设计。
正确答案
72.85%
解析
该实验的产率约为72.85%。(小数点后保留两位有效数字)
考查方向
解题思路
A装置用于Al和氯气反应,B用于产生氯气,C用于干燥气体,D用于除去HCl。E用于干燥,防止AlCl3遇水反应。Cl2中混有的HCl与Al反应生成H2,H2与Cl2混合加热时会发生爆炸。无水氯化铝遇到湿空气产生大量白雾。球形冷凝管和普通分液漏斗相比的优点是可以使液体顺利滴下。
易错点
无水氯化铝遇到湿空气产生大量白雾、制备实验方案的设计。
3.2015年10月5日,中国著名药学家屠呦呦获得诺贝尔奖生理学或医学奖,获奖理由是“因为发现青蒿素—一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命”。青蒿素是从植物黄花蒿茎叶中提取的,其结构简式如右图,下列说法不正确的是( )
正确答案
解析
A.根据有机物的结构简式可知,分子中有7个手性碳原子,分别如图,A错误。
B..根据青蒿素的结构简式可知,它的一个分子中含有的C、H、O三种原子的个数分别是15、22、5个,所以分子式为C15H2205;,B正确;
C.根据青蒿素的结构简式可知青蒿素的分子中含有过氧键,所以是有机过氧化物,有强氧化性,它不稳定,易受湿、热和还原性物质的影响而变质,C正确;
D.青蒿素是有机物,易溶于非极性的有机溶剂,但是青蒿素分子中不含有易溶于水的官能团(即亲水基团),所以在水中的溶解性不大,D正确。
考查方向
解题思路
A.手性碳原子存在于许多有机化合物中,连有四个不同基团的碳原子就是手性碳原子;B.根据青蒿素的结构简式可知,它的一个分子中含有的C、H、O三种原子的个数分别是15、22、5个,所以分子式为C15H2205;C.含有过氧基团的有机化合物称为有机过氧化物。有机过氧化物的氧化性比较强,都是易燃、易爆的化合物,可用作杀菌剂、清毒剂、漂白剂;D.大多数有机物易溶于非极性的有机溶剂(如苯、汽油、四氯化碳、酒精等),但是只有含有易溶于水的官能团(即亲水基团)有—OH、—CHO、—COOH、—NH2时,且亲水基团的个数越多,物质的溶解性越大;
易错点
A.不能正确判断手性碳原子的结构特点;B.没有掌握有机化合物分子式的确定方法;C.没有掌握过氧基团的性质特点;D.对有机化合物的溶解度规律不熟悉。
知识点
8.一氧化碳是一种用途广泛的化工基础原料。有机物加氢反应中镍是常用的催化剂。但H2中一般含有微量CO会使催化剂镍中毒,在反应过程中消除CO的理想做法是投入少量SO2,为弄清该方法对催化剂的影响,查得资料如下:
则:(1)① 不用通入O2氧化的方法除去CO的原因是___________________________。
② SO2(g) + 2CO(g) = S(s) + 2CO2(g) △H =_________________________。
(2)工业上用一氧化碳制取氢气的反应为:CO(g)+H2O(g) 
(3)为减少雾霾、降低大气中有害气体含量, 研究机动车尾气中CO、NOx及CxHy的排放量意义重大。机动车尾气污染物的含量与空/燃比 (空气与燃油气的体积比)的变化关系示意图如图所示,请解释:
①随空/燃比增大,CO和CxHy的含量减少的原因是__________________。
②当空/燃比达到15后,NOx减少的原因可能是_____________。
正确答案
(1)① Ni会与氧气反应
② -270.0KJ/mol
(2)75% , 0.045 mol·L-1·min-1
(3)①空/燃比增大,燃油气燃烧更充分,故CO、CxHy含量减少
②因为反应 N2(g)+O2(g)
解析
(1)①Ni能与氧气反应也会导致其中毒,故答案为:Ni会与氧气反应;
②由图I可知,O2(g)+2CO(g)=2CO2(g)△H=(-2×283)kJ•mol-1=-566kJ•mol-1,(i)
由图II可知,S(s)+O2(g)=SO2(g)△H=-296kJ•mol-1,(ii)
(i)-(ii)得:SO2(g)+2CO(g)=S(s)+2CO2(g)△H=-563-(-298)=-270kJ•mol-1,故答案为:-270kJ/mol;
(2)设参加反应的CO的浓度为x
CO(g)+H2O(g)

所以CO的转化率
氢气反应速率
故答案为:75%;0.045mol/(L•min);
(3)①空/燃比增大,燃油气燃烧更充分,故答案为:空/燃比增大,燃油气燃烧更充分,故CO、CxHy含量减少;
②反应 N2(g)+O2(g)
考查方向
解题思路
(1)①Ni能与氧气反应也会导致其中毒,据此解答即可;
②利用盖斯定律进行计算即可;
(2)根据所给反应的平衡常数,利用三段式法计算出平衡浓度减小求算,
CO(g)+H2O(g)
(3)①燃油气燃烧更充分;
②反应 N2(g)+O2(g)
易错点
(5)中据机动车尾气污染物的含量与空/燃比的变化关系示意图的原因分析
知识点
醋酸镍[(CH3COO)2Ni]是一种重要醋酸镍的工艺流程图如下:
相关离子生成氢氧化物的pH和相关物质的溶解性如下表:
15.调节pH步骤中,溶液pH的调节范围是____________。
16.滤渣1和滤渣3主要成分的化学式分别是____________、_____________。
17.写出氧化步骤中加入H2O2发生反应的离子方程式_____________。
18.酸浸过程中,lmol NiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应的化学方程式_______________。
19.沉镍过程中,若c(Ni2+)=2.0 mol· L-1,欲使100 mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤10-5mol·L-1],则需要加入Na2CO3固体的质量最少为__________g。(保留小数点后1位有效数字)
20.保持其他条件不变,在不同温度下对含镍废料进行酸浸,镍浸出率随时间变化如图。酸浸的最佳温度与时间分别为________℃、_______min。
正确答案
5.0≤pH<6.7
解析
调节pH步骤中,溶液pH的调节范围是5.0≤pH<6.7。
考查方向
解题思路
制取醋酸镍的工艺流程图:
含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)粉碎后加酸浸的过程可将金属化合物离子化,从而得到Ni2+、Al3+、Fe2+、Ca2+,加过氧化氢将S2-和Fe2+氧化,利用相关离子生成氢氧化物的pH和相关物质的溶解性(NiF可溶,CaF微溶,碳酸镍难溶)的不同,除去Al3+、Fe2+、Ca2+最后加纯碱沉淀镍(碳酸镍难溶)并加乙酸制取醋酸镍。
易错点
分析表格利用相关离子生成氢氧化物的pH和相关物质的溶解性(NiF可溶,CaF微溶,碳酸镍难溶)的不同,除去Al3+、Fe2+、Ca2+最后加纯碱沉淀镍(碳酸镍难溶)。
正确答案
SiO2、 CaSO4 CaF2
解析
滤渣1和滤渣3主要成分的化学式分别是SiO2、 CaSO4 CaF2 。
考查方向
解题思路
制取醋酸镍的工艺流程图:
含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)粉碎后加酸浸的过程可将金属化合物离子化,从而得到Ni2+、Al3+、Fe2+、Ca2+,加过氧化氢将S2-和Fe2+氧化,利用相关离子生成氢氧化物的pH和相关物质的溶解性(NiF可溶,CaF微溶,碳酸镍难溶)的不同,除去Al3+、Fe2+、Ca2+最后加纯碱沉淀镍(碳酸镍难溶)并加乙酸制取醋酸镍。
易错点
分析表格利用相关离子生成氢氧化物的pH和相关物质的溶解性(NiF可溶,CaF微溶,碳酸镍难溶)的不同,除去Al3+、Fe2+、Ca2+最后加纯碱沉淀镍(碳酸镍难溶)。
正确答案
2Fe2+ + H2O2 +2H+ == 2Fe3+ + 2H2O
解析
写出氧化步骤中加入H2O2发生反应的离子方程式2Fe2+ + H2O2 +2H+ == 2Fe3+ + 2H2O 。
考查方向
解题思路
制取醋酸镍的工艺流程图:
含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)粉碎后加酸浸的过程可将金属化合物离子化,从而得到Ni2+、Al3+、Fe2+、Ca2+,加过氧化氢将S2-和Fe2+氧化,利用相关离子生成氢氧化物的pH和相关物质的溶解性(NiF可溶,CaF微溶,碳酸镍难溶)的不同,除去Al3+、Fe2+、Ca2+最后加纯碱沉淀镍(碳酸镍难溶)并加乙酸制取醋酸镍。
易错点
分析表格利用相关离子生成氢氧化物的pH和相关物质的溶解性(NiF可溶,CaF微溶,碳酸镍难溶)的不同,除去Al3+、Fe2+、Ca2+最后加纯碱沉淀镍(碳酸镍难溶)。
正确答案
NiS + H2SO4 + 2HNO3 ==
解析
酸浸过程中,lmol NiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应的化学方程式NiS + H2SO4 + 2HNO3 ==
考查方向
解题思路
制取醋酸镍的工艺流程图:
含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)粉碎后加酸浸的过程可将金属化合物离子化,从而得到Ni2+、Al3+、Fe2+、Ca2+,加过氧化氢将S2-和Fe2+氧化,利用相关离子生成氢氧化物的pH和相关物质的溶解性(NiF可溶,CaF微溶,碳酸镍难溶)的不同,除去Al3+、Fe2+、Ca2+最后加纯碱沉淀镍(碳酸镍难溶)并加乙酸制取醋酸镍。
易错点
分析表格利用相关离子生成氢氧化物的pH和相关物质的溶解性(NiF可溶,CaF微溶,碳酸镍难溶)的不同,除去Al3+、Fe2+、Ca2+最后加纯碱沉淀镍(碳酸镍难溶)。
正确答案
31.4g
解析
沉镍过程中,若c(Ni2+)=2.0 mol· L-1,欲使100 mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤10-5mol·L-1],则需要加入Na2CO3固体的质量最少为31.4g g。
考查方向
解题思路
制取醋酸镍的工艺流程图:
含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)粉碎后加酸浸的过程可将金属化合物离子化,从而得到Ni2+、Al3+、Fe2+、Ca2+,加过氧化氢将S2-和Fe2+氧化,利用相关离子生成氢氧化物的pH和相关物质的溶解性(NiF可溶,CaF微溶,碳酸镍难溶)的不同,除去Al3+、Fe2+、Ca2+最后加纯碱沉淀镍(碳酸镍难溶)并加乙酸制取醋酸镍。
易错点
分析表格利用相关离子生成氢氧化物的pH和相关物质的溶解性(NiF可溶,CaF微溶,碳酸镍难溶)的不同,除去Al3+、Fe2+、Ca2+最后加纯碱沉淀镍(碳酸镍难溶)。
正确答案
70 120
解析
保持其他条件不变,在不同温度下对含镍废料进行酸浸,镍浸出率随时间变化如右图。酸浸的最佳温度与时间分别为70℃、120min。
考查方向
解题思路
制取醋酸镍的工艺流程图:
含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)粉碎后加酸浸的过程可将金属化合物离子化,从而得到Ni2+、Al3+、Fe2+、Ca2+,加过氧化氢将S2-和Fe2+氧化,利用相关离子生成氢氧化物的pH和相关物质的溶解性(NiF可溶,CaF微溶,碳酸镍难溶)的不同,除去Al3+、Fe2+、Ca2+最后加纯碱沉淀镍(碳酸镍难溶)并加乙酸制取醋酸镍。
易错点
分析表格利用相关离子生成氢氧化物的pH和相关物质的溶解性(NiF可溶,CaF微溶,碳酸镍难溶)的不同,除去Al3+、Fe2+、Ca2+最后加纯碱沉淀镍(碳酸镍难溶)。
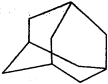
9.下图是金刚烷的结构示意图,1-溴金刚烷可用于合成甲型流感病毒的抑制剂。下列有关说法中正确的是
正确答案
解析
A.从金刚烷的结构简式可以看出金刚烷的分子式为C10H16,金刚烷分子中有10个碳原子,A错误;
B.从金刚烷的结构简式可以看出金刚烷分子含有2种等效氢原子,因此1-溴金刚烷的结构有两种,B正确;
C.烷烃的同系物的通式为:CnH2n+2,金刚烷不属于烷烃的同系物,C错误;
D.金刚烷所有的碳原子都是饱和的,不具有芳香烃相似的化学性质,D错误。
故选B。
考查方向
解题思路
A.从金刚烷的结构简式可以看出金刚烷的分子式为C10H16,金刚烷分子中有10个碳原子;
B.从金刚烷的结构简式可以看出金刚烷分子含有2种等效氢原子,因此1-溴金刚烷的结构有两种;
C.烷烃的同系物的通式为:CnH2n+2,金刚烷不属于烷烃的同系物;
D.金刚烷所有的碳原子都是饱和的,不具有芳香烃相似的化学性质。
易错点
解题注意金刚烷的结构简式可以看出金刚烷分子含有2种等效氢原子。
知识点
扫码查看完整答案与解析