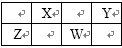- 元素周期律和元素周期表的综合应用
- 共63题
四种短周期元素在周期表中的位置如右图,其中只有M为金属元素。下列说法不正确的是
正确答案
解析
略
知识点
X、Y、Z、W为四种短周期元素,有关这四种元素的说法中一定正确的是
正确答案
解析
略
知识点
短周期主族元素A、B、C、D、E的原子序数依次增大,其中A与C同主族,A与其它元素不在同一周期,B与D同主族,常温下D的单质为淡黄色固体。下列推断中正确的是
正确答案
解析
略
知识点
短周期元素X、Y、Z、W 的原子序数依次增大,且原子最外层电子数之和为14。X 的原子半径比Y 的小, W 单质既可与酸反应又可与碱反应,Z 是地壳中含量最高的元素。下列说法正确的是( )
正确答案
解析
略
知识点
X、Y、Z、W四种元素在元素周期表中的相对位置如下图所示,其中X、W的质子数之和为21,由此可知
正确答案
解析
略。
知识点
下表为元素周期表的一部分,请参照①-⑨相关元素在表中的位置,用化学用语回答下列问题:
(1)④、⑤、⑥的原子半径由大到小的顺序为 。


(4)甲、乙是由②③④三种元素中一种或两种元素形成的双原子分子或负二价阴离子,
它们的电子总数相等,甲与钙元素组成的化合物既含离子键又含非极性共价键,则该化合物的电子式为:__________,乙是一种常用的还原剂,请用化学方程式表示它在工业上的一种重要用途:____________
(5)以⑥的单质材料为阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成有吸附性的难溶物R,写出阳极生成R的电极反应式:____________
(6) 化学方程式: A+B → X+Y+H2O(未配平,反应条件略去)是中学常见反应类型,A、B、X、Y是中学常见的物质,下列反应中A都为单质,请回答:
(ⅰ)若A为红色固体,在加热条件下反应产生有刺激性气味、有漂白作用的气体,写出检验该气体的方法
(ⅱ)若A为黑色粉末,少量A和B常温下反应生成的Y是无色气体,且Y无色,该气体在空气中易变成红棕色,写出常温下少量A和B反应的化学方程式:
(iii)若B为白色乳状物,且溶解度随温度的升高而降低, Y可做固体干燥剂,则该反应在工业上可用于制备
正确答案
见解析。
解析
I.
(2)HNO3>H2CO3>H2SiO3
(3)
(4)
(5)Al-3e-
II.(1)将气体X通入品红溶液中,若品红溶液褪色,加热恢复红色,证明气体X是SO2
(2) Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O
(iii)漂白粉
知识点
下图是元素周期表的一部分,下列说法正确的是
正确答案
解析
略
知识点
元素周期表和元素周期律可以指导人们进行规律性的推测和判断。下列说法不合理的是
正确答案
解析
略
知识点
下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
(1)④、⑤、⑥的原子半径由大到小的顺序为 (填元素符号)。
②、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是 (填化学式)。
(2)①、④、⑤、⑧四种元素中,某些元素间可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式: 。
(3)由表中两种元素的原子按
a,MnO2 b,Na2SO4 c,Na2SO3 d,CaCO3
(4)由表中元素形成的物质X、Y、Z、M、N可发生以下反应:
X溶液与Y溶液反应的离子方程式为 ;
常温下,为使0.1 mol/L M溶液中电离出的阴、阳离子浓度相等,应向溶液中加入一定量的哈Y溶液至pH
正确答案
(1) Na>Al>O HClO4>H3PO4> H2CO3
(2) 
(3)a
(4)Al3++3NH3•H2O→Al(OH)3↓+3NH4+
pH=7
解析
略
知识点
已知X,Y声是元素周期表中前20号元素:|x-y|=3, X, Y能形成化合物M,下列说法正
确的是
正确答案
解析
略
知识点
扫码查看完整答案与解析