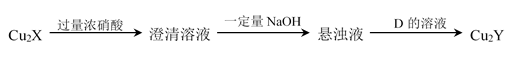- 元素周期律和元素周期表的综合应用
- 共63题
石棉矿是天然纤维状硅酸盐类矿物的总称,可分为蛇纹石石棉矿(又称温石棉矿)和闪石类石棉矿两大类。蛇纹石石棉矿具有优良的性能,在工业中应用广泛,在国防和航天工业中亦有许多用途。
(1)“蛇纹石石棉”的氧化物形式为6MgO•4SiO2•4H2O,其中原子半径最大的元素在周期表中的位置是______________________。Si原子的核外有_____种能量不同的电子,其最外层电子的运动状态有____种。SiO2与NaOH溶液反应的化学方程式为_____________________。
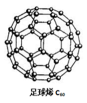
(2)能材料是当今科学研究的热点。氢气作为一种清洁能,必须解决它的储存问题,C60(结构见右图)可用作储氢材料。继C60后,科学家又合成了Si60、N60,下列有关说法正确的是_____。
a. C60、Si60、N60都属于新型化合物
b. C60、Si60、N60互为同分异构体
c.已知N60结构与C60相似,由于N-N键能小于N≡N,故N60的稳定性弱N2
d. 已知金刚石中C-C键长154pm,C60中C-C键长145~140pm,故C60熔点高于金刚石
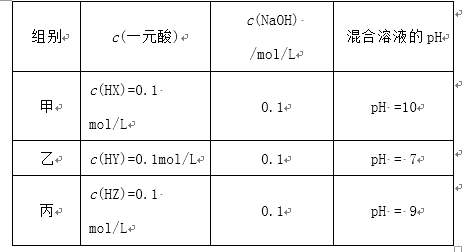
常温下,将a mL 三种一元酸分别和NaOH溶液等体积混合,实验数据如下:
(3)丙组实验发生反应的离子方程式为__________ ,
所得溶液中由水电离出的c(OH-) = _____________ mol/L;
比较此时HX、HY、HZ三种酸的酸性强弱_________>_______>______
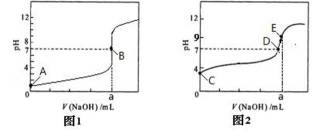
(4)部分实验反应过程中的pH变化曲线如下图:
① 表示乙组实验的pH变化曲线是________________(填图1或图2)
② 上图中表示溶液呈中性的点为_________,表示溶液恰好完全反应的点是_______
正确答案
(1)第三周期第IIA族;5种;4种;SiO2 + 2NaOH →Na2SiO3 + H2O
(2)c
(3)HZ +OH- → H2O + Z-; 1×10-5;HY>HZ>HX
(4)①图1 ②BD,BE
解析
略
知识点
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如右下图所示。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强。下列说法正确的是
正确答案
解析
略
知识点
X、Y、Z、W是元素周期表前四周期中常见的元素,其相关信息如下表:
(1)W位于元素周期表第__________周期第________族,其原子最外层有________个电子。
(2) X的活泼性比Y的____________(填“强”或“弱”);X 和Y的气态氢化物中,较稳定的是______________(写化学式)。
(3)写出Z2Y2的电子式____________ ,XY2的结构式____________。
(4) 在X的原子和氢原子形成的多分子中,有些分子的核磁共振氢谱显示两种氢,写出其中一种分子的名称:_____________。氢元素、X、Y的原子也可共同形成多种分子和某种常见无机阴离子,写出其中一种分子与该无阴离子反应的离子方程式:_____________________________________。
正确答案
(1)四 Ⅷ 2
(2)弱 H20
(3)
(4)丙烷(其它合理答案均可) CH3COOH+HCO2-→CH3COO—+CO2↑+H2O
解析
略
知识点
下表为周期表的一部分,其中的编号代表对应的元素。试填空。
(1)写出上表中元素I的基态原子的电子排布式和价层电子排布图: 。
元素C、D、E、F的第一电离能由大到小的顺序是 (用元素符号表示)。
(2)元素A分别与C、D、E形成最简单的常见化合物分子甲、乙和丙。下列有关叙述不正确的有 。
A.甲、乙和丙分子的空间构型分别为正四面体形、三角锥形、V形
B.甲、乙和丙分子中,中心原子均采取sp3的杂化方式
C.三种分子中键角由大到小的顺序是丙>乙>甲
D.甲、乙和丙分子均为由极性键构成的极性分子
(3)由元素J、C、E组成一种化学式为J(CE)5的配位化合物,该物质常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂。据此可判断:
①该化合物的晶体类型为 。
②该化合物的晶体中存在的作用力有 。
A.离子键 B.极性键 C.非极性键 D.范德华力 E.氢键 F.配位键
③根据共价键理论和等电子体理论分析,CE分子中σ键与π键的数目比为 。
(4)在测定A与F形成的化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是 。
(5)某些不同族元素的性质也有一定的相似性,如表中元素G与元素B,原因是 。
正确答案
(1)1s22s22p63s23p63d54s1(或[Ar]3d54s1) 
(2)CD
(3)①分子晶体 ②BDF ③1∶2
(4)氟化氢气体中存在因氢键而相互缔合形成的缔合分子(HF)n
(5)Be与Al在元素周期表中位于对角线的位置
解析
略
知识点
短周期主族元素X、Y、Z、W、Q的原子序数依次增大,X的气态氢化物极易溶于Y的氢化物中,常温下,Z的单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液。下列说法正确的是 ( )
正确答案
解析
略
知识点
11.下表是元素周期表的一部分,下列有关说法不正确的是( )
正确答案
解析
略
知识点
四种短周期元素在周期表中的位置如图,其中只有M为金属元素。下列说法正确的是
正确答案
解析
略
知识点
短周期元素X、Y、Z、W在元素周期表中的位置如图所示,其中Y所处的周期序数与主族序数之和为8。下列说法错误的是
正确答案
解析
略。
知识点
Q、R、X、Y、Z是原子序数依次增大的五种短周期元素,在短周期的所有元素中Q的原子半径与Z的原子半径之比最小(不包括稀有气体),R、X、Y三种元素的原子核外电子层数相同,同一周期中R的一种单质的熔点最高,Y与Q、R、X、Z均能形成多种常见化合物。
(1)X在周期表中的位置: _____ ,其原子核外有 _______种不同形状的电子云。这五种元素中,最外层有两个未成对电子的元素是 _______(用元素符号表示)。
(2)Q分别与X、Y形成的最简单化合物的稳定性______>______(用分子式表示)
(3) Q与R两元素组成的分子构型可能是 _____(填写序号)。
a.直线型 b.平面形 c.三角锥形 d.正四面体
(4)元素X、Y在周期表中位于同一主族,化合物Cu2X和Cu2Y可发生如下转化(其中D是淀粉水解的最终产物):
非金属X ____ Y(填“>”或“<”),请用事实说明该结论:________________________.
正确答案
(1)第2周期第VA族; 2 ;C O
(2) H2O>NH3
(3) abd
(4)< ; 2H2S + O2
解析
略
知识点
下表中列出五种短周期元素A、B、C、D、E的信息,请推断后回答:
(1)写出C元素在周期表中的位置 ,写出D元素最高价氧化物的水化物电子式 ;
(2)写出B单质与水反应的离子方程式 ;
(3)元素A和D形成的某种化合物可作为呼吸面具中氧气的来源,写出得到氧气反应
的主要化学方程式 ;
(4)X的水溶液显 (填“酸”、“碱”或“中”)性,用离子方程式解释其原因是 ;
(5)已知E元素的某种氢化物Y与A2的摩尔质量相同,Y与空气组成的燃料电池中,电
解质溶液是30%的KOH溶液,该电池放电时正极的电极反应式为 ;
(6)若使用Y—空气燃料电池精炼铜,当得到精铜80 g时,燃料电池中转移的电子数为
NA。
正确答案
见解析。
解析
(1)第三周期 VIA族 ;
(2)Cl2 + H2O
(3)2Na2O2 + 2CO2 == 2Na2CO3 + O2 ;
(4)酸; NH

(5)O2+2H2O+4e- == 4OH- ;
(6)2.5 。
知识点
扫码查看完整答案与解析