- 化学平衡移动原理
- 共39题
在盛有足量M的体积可变的密闭容器中加入N,发生反应:M (s) +2N (g)==4P (s) +Q (g) ΔH<0。在一定温度、压强下达到平衡,平衡是P的物质的量与起始时加入N的物质的量的便能化关系如图所示。下列说法正确的是
正确答案
解析
略
知识点
难溶性杂卤石(K2SO4•MgSO4•2CaSO4•2H2O)属于“呆矿”,在水中存在如下平衡
K2SO4•MgSO4•2CaSO4•2H2O (s)
为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下:
(1)滤渣主要成分有_________和_________以及未溶杂卤石。
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出、K+的原因:__________________。
(3)“除杂”环节中,先加入_________溶液,经搅拌等操作后,过滤,再加入_________溶液调滤液pH至中性。
(4)过滤得到的母液中含有大量的_________(填写化学式),溶液中离子浓度大小顺序为__________________,检验其中溶质阴离子的方法是___________________________。
(5)不同温度下,K+的浸出浓度与溶浸时间的关系如右图,由图可得,随着温度升高
①______________________________________________________
②______________________________________________________
正确答案
(1)CaSO4 Mg(OH)2
(2)氢氧根离子与镁离子结合,使平衡向右移动,K+变多
(3)K2CO3 H2SO4
(4)K2SO4 c(K+)>c(SO42-)>c(H+)=c(OH-)
(5)①在同一时间K+的浸出浓度大。
②反应的速率加快,平衡时溶浸时间短
解析
略
知识点
重铬酸钠俗称红矾钠(Na2Cr2O7·2H2O),是重要的化工产品和强氧化剂。工业制备红矾钠的流程如下:
(1)化学上可将某些盐写成氧化物的形式,如Na2SiO3可写成Na2O·SiO2,则Fe(CrO2)2可写成 。
(2)煅烧铬铁矿时,矿石中难溶的Fe(CrO2)2生成可溶于水的Na2CrO4,反应化学方程式如下:4Fe(CrO2)2+8Na2CO3+7O2 = 2Fe2O3+8Na2CrO4+8CO2 。为了加快该反应的反应速率,可采取的措施是 。(写一种即可)
(3)已知CrO42-在不同的酸性溶液中有不同的反应,如:
2CrO42-+2H+= Cr2O72-+H2O; 3CrO42-+4H+= Cr3O102-+2H2O
① 往混合溶液甲中加入硫酸必须适量的原因是 。
② 混合溶液乙中溶质的化学式是 。
(4)在含Cr2O72-废水中存在着平衡:Cr2O72-+H2O
(5)请配平碱性溶液还原法中发生的离子反应:
□Cr2O72-+□S2-+□H2O ——□Cr(OH)3+□S2O32-+□OH-
正确答案
(1)FeO·Cr2O3
(2)粉碎矿石、升高温度
(3)① 少量不能除尽Na2CO3等杂质,过量会生成Na2Cr3O10等副产物。
② Na2Cr2O7和Na2SO4
(4)
(5) 4 ; 6 ; 19 ; 8 ; 3 ; 14
解析
略
知识点
制烧碱所用盐水需两次精制。第一次精制主要是用沉淀法除去粗盐水中Ca2+、Mg2+、Fe3+、SO42-等离子,过程如下:
Ⅰ. 向粗盐水中加入过量BaCl2溶液,过滤;
Ⅱ. 向所得滤液中加入过量Na2CO3溶液,过滤;
Ⅲ. 滤液用盐酸调节pH,获得一次精制盐水。
(1)过程Ⅰ除去的离子是______。
(2)过程Ⅰ、Ⅱ生成的部分沉淀及其溶解度(20℃/g)如下表:
① 检测Fe3+是否除尽的方法是______。
② 过程Ⅰ选用BaCl2而不选用CaCl2,运用表中数据解释原因______。
③ 除去Mg2+的离子方程式是______。
④ 检测Ca2+、Mg2+、Ba2+是否除尽时,只需检测Ba2+即可,原因是_____。
(3)第二次精制要除去微量的I-、IO3-、NH4+、Ca2+、Mg2+,流程示意如下:
① 过程Ⅳ除去的离子是______。
② 盐水b中含有SO42-。Na2S2O3将IO3- 还原为I2的离子方程式是______。
③ 过程VI中,在电解槽的阴极区生成NaOH,结合化学平衡原理解释:_______。
正确答案
见解析。
解析
(1)SO42-
(2)① 取少量过程II后的滤液于试管中,滴加几滴KSCN 溶液,若溶液不变红,说明
Fe 3+已除尽;反之没除尽
② BaSO4的溶解度比CaSO4的小,可将SO42-沉淀更完全
③ 2Mg2+ + 2CO32- + H2O == Mg2(OH)2CO3↓+ CO2↑
④ 在BaCO3、CaCO3、Mg2(OH)2CO3 中,BaCO3的溶解度最大,若Ba2+沉淀完全,则说明Mg2+ 和Ca2+也沉淀完全
(3)① NH4+、I-
② 5S2O32- + 8IO3- + 2OH- == 4I2 + 10SO42- + H2O
③ H+在阴极上得电子变成H2逸出,使H2O
知识点
T℃时,某一气态平衡体系中含有X(g)、Y(g)、Z(g)、W(g)四种物质,此温度下发
生反应的平衡常数表达式为:
正确答案
解析
略
知识点
在三种不同条件下,分别向容积为2L的恒容容器中加入2molA和1molB,发生反应如下:2A(g)+B(g) 
正确答案
解析
略。
知识点
10.在容积不变的密闭容器中,一定条件下发生反应:
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
13.在某固定容积的密闭容器中充入1molA,一定条件下建立如下化学平衡:aA(g)
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
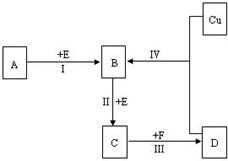
28.非金属元素X、Y位于短周期的相邻周期、相邻主族,它们的最高价氧化物的水化物均为强酸。根据下图转化关系(反应条件及部分产物已略去),回答下列问题:
(1)若A、B、C、D均为含X元素的化合物,且A的一个分子中只含有10个电子,则:
①A分子的空间构型为( )。
②反应I的化学方程式为( )。
(2)若A、B、C、D均为含Y元素的化合物,且A的摩尔质量为120g/mol,则:
①工业上实现反应I的化工设备的名称是_____________。
②在一个固定容积为5L的密闭容器中充入0.20 mol B和0.10mol E,半分钟后达到平衡,测得容器中含C 0.18mol,则v(E)=( )mol· L-1.min-1;若继续通入0.20mol B和0.10mol E,则平衡向( ) 移动,再次达到平衡后,( )mol<n(C)<( )mol。
③含Y元素的化合物Na2Y5和次氯酸钠溶液在强碱性环境中能发生反应,产物无沉淀,该反应的离子反应方程式为( )。
正确答案
(1)①三角锥形 ②4NH3+5O2
(2)①沸腾炉 ②0.036 正反应 0.36 0.40
③S52-+16ClO-+8OH-=5SO42-+16Cl-+4H2O
解析
解析已在路上飞奔,马上就到!
知识点
11.密闭容器中X、Y、Z三种气体的初始浓度和不同温度下的平衡浓度如下表:下列说法错误的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析