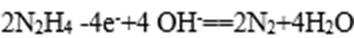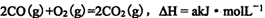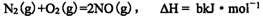- 化学基本概念和基本理论
- 共1765题
氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
(1)氮元素原子的L层电子数为 ;
(2)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为 ;
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)= N2H4 (1) △H1= -19.5kJ·mol-1
②N2H4 (1) + O2(g)= N2(g) + 2 H2O(g) △H2= -534.2kJ·mol-1
写出肼和N2H4 反应的热化学方程式 ;
(4)肼一空气燃料电池是一种碱性电池,该电池放电时,负极的反应式为 。
正确答案
(1)5
(2)2NH3+NaClO==N2H4+NaCl+H2O
(3)2N2H4 (1)+N2O4(1)==3N2(g)+4H2O(g) △H2= -1048.9kJ·mol-1
(4)
解析
(1)N原子的原子结构示意图为: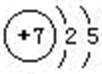
(2)NH3+NaClO——N2H4,根据元素守恒还应生成NaCl和H2O,观察法可配平方程式为 2NH3+NaClO==N2H4+NaCl+H2O;
(3)肼与N2O4反应生成N2和水蒸气:2N2H4 +N2O4==3N2+4H2O,观察已知的两个热方程式可知,②×2-①得:2N2H4 (1)+N2O4(1)==3N2(g)+4H2O(g) △H2= -1048.9kJ·mol-1
(4)“肼一空气燃料电池是一种碱性电池”中O2在正极反应,故负极是肼发生反应:
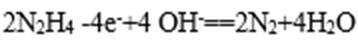
知识点
金属钙线是炼制优质钢材的脱氧脱磷剂,某钙线的主要成分为金属M和

(1)
(2)

(3)配平用钙线氧脱鳞的化学方程式:
P+ FeO+ CaO

(4)将钙线试样溶于稀盐酸后,加入过量


(5)取1.6g钙线试样,与水充分反映,生成224ml.


正确答案
(1)第四周期第ⅡA族,
(2) 
(3)2P+5FeO+3CaO
(4)Fe;Fe+3SCN-=Fe(SCN)3
(5)1.1
解析
本题考查钙、铁的知识。
(1)Ca为20号,位于第四周期,第IIA族。
(2)最活泼的金属为:F, 







(5)








知识点
8.某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
(1)NaN3是气体发生剂,受热分解产生N2和Na,N2的电子式为( )
(2)Fe2O3是主氧化剂,与Na反应生成的还原产物为( )(已知该反应为置换反应).
(3)KClO4是助氧化剂,反应过程中与Na作用生成KCl和Na2O,KClO4含有化学键的类型为 ( ),K的原子结构示意图为( )。
(4)NaHCO3是冷却剂,吸收产气过程中释放的热量而发生分解,其化学方程式为( )。
(5)100g上述产气药剂产生的气体通过碱石灰后得到N2 33.6L(标准状况)。
用碱石灰除去的物质为 ( );
②该产气药剂中NaN3的质量分数为( )。
正确答案
(1)
(2)Fe
(3)离子键和共价键,
(4)
(5)①
解析
解析已在路上飞奔,马上就到!
知识点
(1)元素M的离子与
(2)硫酸铝溶液与过量氨水反应的离子方程式为 。
(3)能证明



(填序号)。
a滴入酚酞溶液变红,再加入
b滴入酚酞溶液变红,再加入氯水后红色退去
c滴入酚酞溶液变红,在加入
(4)元素X、Y在周期表中位于同一主族,化合物

①非金属X Y(填:“<”或“<”)
②
(5)在恒容绝热(不与外界交换能量)条件下进行2A(g)+B(g)
正确答案
见解析。
解析
(1)写出M原子的结构示意图:
(2)Al3++3NH3H2O===Al(OH)3↓+3NH4+
(3)选C;C能证明既有反应物又有生成物。
酚酞检验OH-;A中H2SO4消耗的是OH-;B中加入氯水后红色褪去,可能是氯水直接和OH-反应。C中加入BaCl2后产生白色BaSO3沉淀,可见原体系中含有SO32-
(4)①<;
通过砖红色的Cu2Y可判断出Y是O元素(葡萄糖与菲林试剂反应生成砖红色的氧化亚铜Cu2O沉淀)
②Cu2O+6HNO3===2Cu(NO3)2+2NO2↑+3H2O
(5)温度越高,平衡常数越小。
因为从表格数据得知,D物质的量为0,平衡一定会向正方向移动,(气体体积减小)而从题干信息得知,压强升高,在恒容绝热下那一定是因为放热导致容器温度升高,从而使得压强增大,推出正方向放热。
知识点
(1)磷、硫元素的单质和化合物应用广泛。
1)磷元素的原子结构示意图是____________。
2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2=6CaSiO3+P4O10 10C+P4O10=P4+10CO
每生成1 mol P4时,就有________mol电子发生转移。
3)硫代硫酸钠(Na2S2O3)是常用的还原剂。在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C完全氧化,剩余的I2用Na2S2O3溶液滴定,可测定溶液中维生素C的含量。发生的反应为:
C6H8O6+I2=C6H6O6+2H++2I- 2S2O32-+I2=S4O62-+2I-
在一定体积的某维生素C溶液中加入a mol·L-1 I2溶液V1 mL,充分反应后,用Na2S2O3溶液滴定剩余的I2,消耗b mol·L-1 Na2S2O3溶液V2 mL。该溶液中维生素C的物质的量是__________mol。
4)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:
2IO3-+5SO32-+2H+=I2+5SO42-+H2O
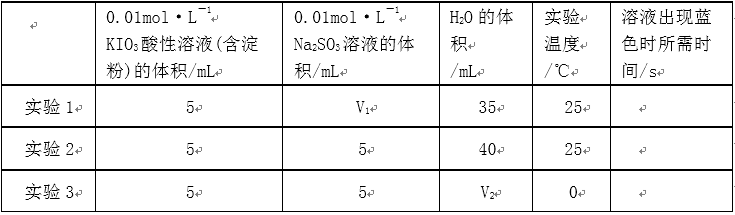
生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。某同学设计实验如下表所示:
该实验的目的是_____________;表中V2=___________mL。
(2)、稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位。
5)铈(Ce)是地壳中含量最高的稀土元素。在加热条件下CeCl3易发生水解,无水CeCl3可用加热CeCl3·6H2O和NH4Cl固体混合物的方法来制备。其中NH4Cl的作用是______________。
6)在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离。完成反应的离子方程式:
____Ce3++____H2O2+____H2O =____Ce(OH)4↓+____ _______
正确答案
见解析。
解析
1)写出P原子的结构示意图: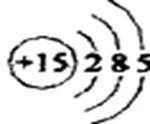
2)每生成1 mol P4时,P由+5价变成0价,电子转移为5×4=20或C化合价由0价变成为+2价,电子转移为2×10=20;
3)n(Na2S2O3)=bV1/1000 mol;与其反应的I2为bV1/2000 mol,与维生素C反应的I2为 
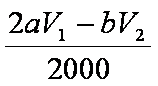
4)由实验2可以看出混合液的总体积为50mL,V1为10mL,V2为40mL,实验1和实验2可知实验目的是探究该反应速率与亚硫酸钠溶液浓度的关系;实验2和实验3可知实验目的是探究该反应速率与温度的关系。
5)题目中给出:“加热条件下CeCl3易发生水解”,可知NH4Cl的作用是肯定是抑制水解的,CeCl3水解会生成HCl,可以完整答出:NH4Cl的作用是分解出HCl气体,抑制CeCl3水解。
6)根据题意:“强酸性”或观察方程式可知缺项是H+,利用电子得失守恒或观察法就可以配平方程式。2Ce3++H2O2+6H2O= 2Ce(OH)4↓+6H+
知识点
月球含有H、He、N、Na、Mg、Si等元素,是人类未来的资源宝库。
(1)3He是高效能原料,其原子核内的中子数为
(2)Na的原子结构示意图为 ,Na在氧气中完全燃烧所得产物的电子式为
(3)MgCl2在工业上应用广泛,可由MgO制备。
①MgO的熔点比BaO的熔点 (填“高”或“低”。)
②月球上某矿石经处理得到的MgO中含有少量SiO2,除去SiO2的离子方程式为;SiO2的晶体类型为 。
③MgO与碳粉和氯气在一定条件下反应可制备MgCl2。若尾气可用足量NaOH溶液完全吸收,则生成的盐为(写化学式)。
(4)月壤中含有丰富的3He,从月壤中提炼1kg 3He,同时可得6000kg H2和700kg N2,若以得到H2和N2为原料经一系列反应最多可生产碳酸氢铵 kg
正确答案
答案:
(3)①高 ②SiO2+2OH-=SiO32-+H2O;原子晶体 ③NaCl,NaClO,Na2CO3
(4)3950
解析
略
知识点
铁及其化合物之间的相互转化可用下式表示:
回答下列有关问题:
(1)铁元素位于元素周期表的第四周期第VIII族,原子序数是26,最外层有2个电子。元素铁的原子结构示意图是________。
(2)硫酸亚铁溶液中加入H2O2 氧化时,发生反应的化学方程式为________;检验硫酸铁溶液中是否存在Fe2+的方法是________。
(3)____Fe(OH)3 +____NaClO+____
(4)高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾强,其本身在反应中被还原为Fe3+。Na2FeO4之所以能净水,除了能消毒杀菌外,另一个原因是________。
正确答案
(1)
(2) H2O2+H2SO4+2FeSO4=Fe2(SO4)3+2H2O;将适量硫酸铁溶置于洁净试管中,滴加几滴酸性高锰酸钾溶液,充分反应后,溶液紫色退去,则证明其中含有Fe2+,否则不含。
(3)2;3;4NaOH;2;3;5
(4)六价铁被还原成三价铁,三价铁水解生成氢氧化铁胶体,具有较大的表面积,能吸附杂质而沉降下来达到净水的目的
解析
略。
知识点
23.(1)M由两种短周期元素组成,每个M分子含有18个电子,其分子球棍模型如右图所示。测得M的摩尔质量为32g/mol。画出编号为2的原子结构示意图:( )。
(2)已知1.0mol·L—1NaHSO3溶液的pH为3.5,加入氯水,振荡后溶液pH迅速降低。溶液pH降低的原因是 ( ) (用离子方程式表示)。
(3)在常温常压和光照条件下,N2在催化剂(TiO2)表面与H2O反应,生成1molNH3和O2时的能量变化值为382.5kJ,达到平衡后此反应NH3生成量与温度的实验数据如下表。则该反应的热化学方程式为 ( ) 。
(4)在溶液中,一定浓度的NH4+能溶解部分Mg(OH)2固体,反应如下:
2NH4+(aq) + Mg(OH)2(s) Mg2+(aq)+2NH3·H2O(aq) 写出上述反应的平衡常数表达式( );某研究性学习小组为探究Mg2+与NH3·H2O反应形成沉淀的情况,设计如下两组实验
请分析实验①、②产生不同现象的原因:( )。
(5) 在室温下,化学反应I–(aq)+ ClO–(aq) = IO–(aq) + Cl–(aq)的反应物初始浓度、溶液中的氢氧根离子初始浓度及初始速率间的关系如下表所示:
已知表中初始反应速率与有关离子浓度关系可以表示为v= k [I–]1 [ClO–]b [OH–]c(温度一定时,k为常数)。
①设计实验2和实验4的目的是( ) ;
②若实验编号4的其它浓度不变,仅将溶液的酸碱值变更为pH = 13,反应的初始速率v= ( ) 。
23.

(2)已知1.0mol·L—1NaHSO3溶液的pH为3.5,加入氯水,振荡后溶液pH迅速降低。溶液pH降低的原因是 (用离子方程式表示)。
(3)在常温常压和光照条件下,N2在催化剂(TiO2)表面与H2O反应,生成1molNH3和O2时的能量变化值为382.5kJ,达到平衡后此反应NH3生成量与温度的实验数据如下表。则该反应的热化学方程式为 。
(4)在溶液中,一定浓度的NH4+能溶解部分Mg(OH)2固体,反应如下:
2NH4+(aq) + Mg(OH)2(s) 
写出上述反应的平衡常数表达式
某研究性学习小组为探究Mg2+与NH3·H2O反应形成沉淀的情况,设计如下两组实验
请分析实验①、②产生不同现象的原因:
。
(5) 在室温下,化学反应I–(aq)+ ClO–(aq) = IO–(aq) + Cl–(aq)的反应物初始浓度、溶液中的氢氧根离子初始浓度及初始速率间的关系如下表所示:
已知表中初始反应速率与有关离子浓度关系可以表示为v= k [I–]1 [ClO–]b [OH–]c(温度一定时,k为常数)。
①设计实验2和实验4的目的是 ;
②若实验编号4的其它浓度不变,仅将溶液的酸碱值变更为pH = 13,反应的初始速率v= 。
正确答案
请考生从给出的3道物理题、3道化学题、2道生物题中每科任选一题做答。
36.以硫酸工业的SO2尾气、氨水、石灰石、焦炭、碳酸氢铵和氯化钾等为原料,可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质。合成路线如下:
(1)写出反应Ⅰ的化学方程式 ( ) 。
(2)生产中,向反应II中的溶液中加入适量还原性很强的对苯二酚等物质,其目的是( )。
(3)下列有关说法正确的是( ) 。
a.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙
b.反应III中氧化剂与还原剂的物质的量之比为4︰1
c.反应IV需控制在60~
d.反应V中的副产物氯化铵可用作氮肥
(4)反应Ⅴ在25℃、40%乙二醇溶液中进行,不断有硫酸钾晶体从溶液中析出,硫酸钾的产率会超过90%,选用40%乙二醇溶液的原因是( )。
(5)(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,写出二氧化氮与亚硫酸铵反应的化学方程式( ) 。37.[Cu(NH3)4]SO4·H2O是一种杀虫剂。
(1)Cu元素基态原子的电子排布式为___ ____。
(2)元素N、O、S的第一电离能由大到小排列的顺序为___ __。
(3)H元素可与O元素形成H2O和H2O2,H2O2易溶于H2O,其主要原因为___ ___。
(4)H元素与N元素可组成化合物N2H4,其中N原子的轨道杂化方式为___ ___。
(5)与SO互为等电子体的一种分子的化学式为 ___ ___。
(6)Cu元素与H元素可形成一种红色晶体,其结构如图8,则该化合物的化学式为__ __。38.菠萝酯是一种具有菠萝香气的食用香料,是化合物甲与苯氧乙酸
(1)甲一定含有的官能团的名称是( ) 。
(2)5.8g甲完全燃烧可产生0.3mol CO2和0.3 mol H2O,甲蒸气对氢气的相对密度是29,甲分子中不含甲基,且为链状结构,其结构简式是( )。
(3)苯氧乙酸有多种酯类的同分异构体,其中能与FeCl3溶液发生显色反应,且有2种一硝基取代物的同分异构体是(写
(4)已知:R-C

R-ONa
菠萝酯的合成路线如下:
①试剂X不可选用的是(选填字母)( ) 。
a. CH3COONa溶液
b. NaOH溶液
c. NaHCO3溶液
d.Na
②丙的结构简式是 ( ),反应II的反应类型是 ( ) 。
③反应IV的化学方程式是( ) 。
37.[Cu(NH3)4]SO4·H2O是一种杀虫剂。
(1)Cu元素基态原子的电子排布式为___ ____。
(2)元素N、O、S的第一电离能由大到小排列的顺序为___ __。
(3)H元素可与O元素形成H2O和H2O2,H2O2易溶于H2O,其主要原因为______。
(4)H元素与N元素可组成化合物N2H4,其中N原子的轨道杂化方式为___ ___。
(5)与SO互为等电子体的一种分子的化学式为___ ___。
(6)Cu元素与H元素可形成一种红色晶体,其结构如图8,则该化合物的化学式为____。
38.菠萝酯是一种具有菠萝香气的食用香料,是化合物甲与苯氧乙酸
(1)甲一定含有的官能团的名称是( )。
(2)5.8g甲完全燃烧可产生0.3mol CO2和0.3 mol H2O,甲蒸气对氢气的相对密度是29,甲分子中不含甲基,且为链状结构,其结构简式是 ( )。
(3)苯氧乙酸有多种酯类的同分异构体,其中能与FeCl3溶液发生显色反应,且有2种一硝基取代物的同分异构体是(写出任意2种的结构简式)( ) 。
(4)已知:
菠萝酯的合成路线如下:
①试剂X不可选用的是(选填字母)( ) 。
a. CH3COONa溶液
b. NaOH溶液
c. NaHCO3溶液
d.Na
②丙的结构简式是( ),反应II的反应类型是( ) 。
③反应IV的化学方程式是( ) 。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
请考生从给出的3道物理题、3道化学题、2道生物题中每科任选一题做答。
36. (1)钢铁工业对促进经济和社会发展起了重要作用。
①不锈钢含有的Cr元素是在炼钢过程的氧吹( )(填“前”或“后”)加入。
②炼钢时,加入硅、锰和铝的目的是( ) 。
③炼铁和炼钢生产中,尾气均含有的主要污染物是( ) 。从环保和经济角度考虑,上述尾气经处理可用作 ( ) 。
(2)纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺。
①“氨碱法”产生大量CaCl2废弃物,写出该工艺中产生CaCl2的化学方程式:( );
②写出“联合制碱法”有关反应的化学方程式:( ) ;
③CO2是制碱工业的重要原料,“联合制碱法”与“氨碱法”中CO2的来源有何不同?( ) 。
37. 碳元素不仅能形成丰富多彩的有机化合物,而且还能形成多种无机化合物,同时自身可以形成多种单质,碳及其化合物的用途广泛。
(1)C60分子中每个原子接2个单键和一个双键,它与F2发生加成反应,其加成产物为 ( );C60的晶体中,每个C60晶胞的质量为( )。(用含NA的式子表示)
(2)干冰和冰是两种常见的分子晶体,下列关于两种晶体的比较中正确的是( ) 。
a.晶体的密度:干冰>冰 b.晶体的熔点:干冰>冰
c.晶体中的空间利用率:干冰>冰 d.晶体中分子间相互作用力类型相同
(3)金刚石和石墨是碳元素形成的两种常见单质,下列关于这两种单质的叙述中正确的有:( )
a.金刚石中碳原子的杂化类型为sp3杂化,石墨中碳原子的杂化类型为sp2杂化;
b.晶体中共价键的键长:金刚石中C—C<石墨中C—C;
c.晶体的熔点:金刚石>石墨
d.晶体中共价键的键角:金刚石>石墨
e.金刚石晶体中只存在共价键,石墨晶体中则存在共价键、金属键和范德华力;

(4)金刚石晶胞结构如图,立方BN结构与金刚石相似,在BN晶体中,B原子周围最近的N原子所构成的立体图形为( )B原子与N原子之间共价键与配位键的数目比为( ),一个晶胞中N原子数目为( ) 。
(5)C与孔雀石共热可以得到金属铜,铜原子的原子结构示意图为( ),金属铜采用面心立方最密堆积,则Cu的晶体中Cu原子的配位数为( )。已知Cu单质的晶体密度为
38. 有机物A的分子式为C9 H10 O2,A在光照条件下生成的一溴代物B,可发生如下转化关系(无机产物略):
其中K物质与氯化铁溶液发生显色反应,且环上的一元取代物只有两种结构。
已知:①当羟基与双键碳原子相连时,易发生如下转化:RCH=CHOH→RCH2CHO;
② —ONa连在烃基上不会被氧化。
请回答下列问题:
(1)F与I中具有相同的官能团,检验该官能团的试剂是( )。
(2)上述变化中属于水解反应的是( )(填反应编号)。
(3)写出结构简式,G:( ),M:( ) 。
(4)写出下列反应的化学方程式:反应①:( ),K与少量的氢氧化钠溶液反应: ( )。
(5)同时符合下列要求的A的同分异构体有( )种。
I.含有苯环 Ⅱ.能发生银镜反应和水解反应
Ⅲ.在稀氢氧化钠溶液中,1mol该同分异构体能与1mol NaOH反应
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
10.根据原子结构及元素周期律的知识,下列推断正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28.Ag/α-Al2O3是石油化学工业的一种重要催化剂,其中Ag起催化作用,α-Al2O3是载体且不溶于硝酸,该催化剂的回收实验如下图所示。其中的转化反应为:6AgCl+Fe2O3→3Ag2O+2FeCl3
阅读上述实验流程,完成下列填空:
(1)Ag/α-Al2O3加酸溶解应该选用装置( )(选填a、b、c)。
(2)在实验操作(Ⅱ),如果用自来水代替蒸馏水进行洗涤,将会发生化学反应的离子方程式( )。
(3)实验操作(Ⅳ)所需玻璃仪器为( )(填写三种)。
(4)实验操作(Ⅶ)从AgNO3溶液获得AgNO3晶体需要进行的实验操作依次为( )(多选扣分)。
a蒸馏 b蒸发 c灼烧 d冷却结晶
(5)已知:
NO和NO2的混合气体的组成可表示为NOx。该混合气体通入NaOH溶液被完全吸收时,x的值为( )
a x<1.5 b x=1.2 c X≥1.5
(6)已知Ag/α-Al2O3中Ag的质量分数,若计算Ag的回收率,还必须知道的实验数据为( )和( )。
正确答案
(1)a
(2)Ag++Cl-=AgCl↓
(3)漏斗、烧杯、玻璃棒
(4)b、d
(5)c
(6)催化剂的质量 AgNO3的质量
解析
解析已在路上飞奔,马上就到!
知识点
9.下列叙述中正确的是( )
①标准状况下,lL HCl和lL H2O的物质的量相同
②标准状况下,lg H2和14g N2的体积相同
③28gCO的体积为22.4L
④两种物质的物质的量相同,则它们在标准状况下的体积也相同
⑤在同温同体积时,气体的物质的量越大。则压强越大
⑥同温同压下,气体的密度与气体的相对分子质量成正比
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
23. I.黑火药爆炸时发生多种化学反应,其中主要化学反应方程式为:
(1)上述反应中,原子半径最小的元素其原子结构示意图为____;
(2)上述反应中,每生成Imol氧化产物转移电子的物质的量为( )mol;
(3)收集黑吠药爆炸后的烟尘和气体产物,分别与酸性高锰酸钾溶液反应,均能使溶液紫红色退去。
①烟尘中能使酸性高锰酸钾溶液退色的物质的化学式是( )。
②气体产物与酸性高锰酸钾溶液反应的离子方程式( ),
II.汽车尾气中含有NO和CO等有害气体。选择适当的催化剂可将CO、NO转化为无毒气体。
(4)已知:
写出NO转化为无毒气体的热化学反应方程式____;
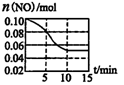
反应过程中NO气体的物质的量与时间的关系如图所示。
①0~5minNO的平均反应速率
②平衡时测得绝热容器内的压强比反应前增大,关于该反应
的说法正确的是____(填选项)
A.是气体分子数增多的反应
B.升高温度平衡常数减小
C.反应物的总能量小于生成物的总能量
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
23.下表所列是元素周期表部分短周期的主族元素
已知R为地壳中含量最多的金属元素。
(1)写出Z的原子结构示意图________。
(2)W与氢原子形成6原子分子的结构简式_______。
(3)超细RX粉末被应用于大规模集成电路领域。其制作原理为R2Y3.X2.W在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1:1;其反应的化学方程式为_______。
(4)X最高价氧化物对应水化物与X气态氢化物反应的生成物溶于水中,所得溶液离子浓度从大到小的顺序是_______。
(5)火箭发动机的燃料胼(N2H4)与氧化剂N204反应生成N2和水蒸气。

写出肼和N2O4反应的热化学方程式______________。
(6)温度为T时,向2.0 L恒容密闭容器中充入1.00 mol PCl5,反应

相同温度下,起始时向容器中充入1.00 mol PC15.0.20 mol PCl3和0.40 mol Cl2,反应达到平衡前v(正) _______v(逆)(填“>”或“=”或“<”);原因是_______。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析