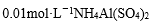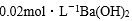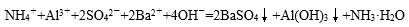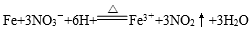- 化学基本概念和基本理论
- 共1765题
半水煤气是工业合成氨的原料气,其主要成分是H2、CO、CO2、N2和H2O(g)。半水煤气经过下列步骤转化为合成氨的原料。
完成下列填空:
37.半水煤气含有少量硫化氢。将半水煤气样品通入____溶液中(填写试剂名称),出现_______,可以证明有硫化氢存在。
38.半水煤气在铜催化

若半水煤气中V(H2):V(CO):V(N2)=38:28:22,经CO变换后的气体中:V(H2):V(N2)=____________。
39.碱液吸收法是脱除二氧化碳的方法之一。已知:
若选择Na2CO3碱液作吸收液,其优点是__________;缺点是____________。如果选择K2CO3碱液作吸收液,用什么方法可以降低成本?
___________________________________________
写出这种方法涉及的化学反应方程式。_______________________
40.以下是测定半水煤气中H2以及CO的体积分数的实验方案。
取一定体积(标准状况)的半水煤气,经过下列实验步骤测定其中H2以及CO的体积分数。
(1) 选用合适的无机试剂分别填入Ⅰ、Ⅰ、Ⅳ、Ⅴ方框中。
(2) 该实验方案中,步骤________(选填“Ⅳ”或“Ⅴ”)可以确定半水煤气中H2的体积分数。
正确答案
硝酸铅(或硫酸铜);黑色沉淀
解析
硫化氢能与重金属生成沉淀,所以将半
考查方向
解题思路
硫化氢能与重金属生成沉淀。
易错点
未掌握硫化氢的检验方法。
正确答案
3:1
解析
由转化的方程式,V(H2):V(N2)=(28+38):22=3:1
考查方向
解题思路
若半水煤气中V(H2):V(CO):V(N2)=38:28:22,经CO变换后CO转化为氢气,则根据方程式可知所得的气体中:V(H2):V(N2)=(38+28):22=3:1。
易错点
不能找到H2 和N2之间的逻辑关系。
正确答案
价廉;吸收CO2能力差
碱液循环使用;2KHCO3→K2CO3+CO2↑+H2O
解析
从题给价格看,明显Na2CO3碱液更便宜,价廉;但是吸收CO2能力差;由于生成的KHCO3受热可以易分解,生成的碱液循环使用,乙降低成本;方程式为:2KHCO3
考查方向
解题思路
根据表中数据可知若选择Na2CO3碱液作吸收液,其优点是价廉,而缺点是吸收CO2能力差。由于生成的碳酸氢钾受热易分解产生碳酸钾,所以使碱液循环使用可以降低成本,反应的化学方程式为2KHCO3→K2CO3+CO2↑+H2O;
易错点
未能读懂并捕捉到全部相关信息。
正确答案
(1)
(2)IV
解析
(1)因半水煤气中含有CO2,先利用碱液吸收后干燥,然后通过CuO和H2、CO反应,利用浓硫酸稀释产生的水蒸气,利用碱液吸收产生的二氧化碳,进而计算体积分数。(2)氢气还原氧化铜生成水蒸气,浓硫酸吸收水蒸气,所以该实验方案中,步骤Ⅳ可以确定半水煤气中H2的体积分数。
考查方向
解题思路
(1)首先利用碱液除去二氧化碳,干燥后再通过氧化铜反应,利用浓硫酸稀释产生的水蒸气,利用碱液吸收产生的二氧化碳,进而计算体积分数。(2)氢气还原氧化铜生成水蒸气,浓硫酸吸收水蒸气。
易错点
流程的设计和评价考虑不周全。不清楚步骤Ⅳ的作用。
下列离子方程式表达正确的是
正确答案
解析
略
知识点
下列结实实验现象的反映方程式正确的是( )
正确答案
解析
A项,钠在常温下暴露在空气中,钠被空气中氧气氧化成氧化钠:4Na+O2=2Na2O,A项错误。B项,硫化银的溶度积小于氯化银的溶度积,在难溶电解质转化过程中,溶度积较大的难溶电解质转化成溶度积较小的电解质,该离子方程式正确,B项正确。C项,过氧化钠在潮湿空气中放置一段时间,变成白粘稠物,是由于过氧化钠与空气中水蒸汽、二氧化碳反应:2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑,C项错误。D项,向碳酸氢钠溶液中加入过量的澄清石灰水,碳酸氢钠少量,取碳酸氢钠为1mol,需要1mol氢氧化钙反应:
NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2O,离子方程式为Ca2++OH-+HCO3-=CaCO3↓+H2O,D项错误。
知识点
下列离子方程式正确的是
正确答案
解析
本题考查离子方程式的书写判断。A项的电荷不守恒,A项错误;醋酸是弱酸,不能拆,B项错误;NH4Al(SO4)2与Ba(OH)2以1:2的比值混合,OH—恰与NH4+和Al3+完全反应,C项正确;硝酸与过量Fe反应得到的是Fe2+,D项错误。
知识点
下列离子方程式书写正确的是( )
正确答案
解析
解析:A项正确的离子方程式应为:2H+ + SO42- + Ba2+ + 2OH-=BaSO4↓+2 H2O;B项中氯气不足量,只能氧化Fe2+ ,B项错误;C项中稀硝酸具有强氧化性,能将硫化氢氧化,故不可能产生硫化氢气体,C项错误。
知识点
下列表示对应化学反应的离子方程式正确的是
正确答案
解析
本题是基本概念中离子方程式判断正误的考查,选题以元素化合物基础和生活内容为背景。
A.电荷不守恒,离子方程式要注意三守恒(元素、电子、电荷)等。
B.NO2与水的反应生成硝酸和NO,仅硝酸可折成离子。
C.用食醋除去水瓶中的水垢涉及到弱电解质及难溶物质的书写,碳酸钙不拆,内容来源于必修二P75页的课本内容。
D.向NaAlO2溶液中通入过量CO2的产物是Al(OH)3↓+HCO32-,本选项对部分学生有难度,但在单项选择题可以用排除法解决。
知识点
能正确表示下列反应的离子方程式是
正确答案
解析
略
知识点
下列表示对应化学反应的离子方程式正确的是
正确答案
解析
本题是基本概念中离子方程式判断正误的考查,选题以元素化合物基础和生活内容为背景。
A一定要注意酸性溶液中不能出现OH-。B选项中 NH4HCO3溶液HCO3-也能与NaOH反应。C过量二氧化硫气体入冷氨水只能酸式盐。D得失电子不守恒。
知识点
能正确表示下列反应的离子方程式是
正确答案
解析
A答案中氨水是弱电解质,应写成分子式,错误;B中澄清石灰水应写成离子形式,错误;D答案中铁粉与稀硫酸反应生成亚铁离子,错误。
知识点
下列解释事实的方程式不正确的是
正确答案
解析
略
知识点
下表中评价合理的是
正确答案
解析
A项注意的是HNO3把+2价的铁也氧化为+3价了,但HNO3应还原为NO气体,故A项评价错误;B项的碳酸镁为微溶物,写离子方程式时应保持化学式;B项评价正确;C项的离子方程式错误,正确为2NH4+ +SO42-+Ba2++2OH-=BaSO4↓+2NH3·H2O;D项的反应是正确的,故D项评价错误。
知识点
下列离子方程式正确的是
正确答案
解析
HClO 是弱电解质不拆,Cu做电解池电极时参加反应失电子做阳极。
知识点
下列表示对应化学反应的离子方程式正确的是
正确答案
解析
略
知识点
(1)元素M的离子与
(2)硫酸铝溶液与过量氨水反应的离子方程式为 。
(3)能证明



(填序号)。
a滴入酚酞溶液变红,再加入
b滴入酚酞溶液变红,再加入氯水后红色退去
c滴入酚酞溶液变红,在加入
(4)元素X、Y在周期表中位于同一主族,化合物

①非金属X Y(填:“<”或“<”)
②
(5)在恒容绝热(不与外界交换能量)条件下进行2A(g)+B(g)
正确答案
见解析。
解析
(1)写出M原子的结构示意图:
(2)Al3++3NH3H2O===Al(OH)3↓+3NH4+
(3)选C;C能证明既有反应物又有生成物。
酚酞检验OH-;A中H2SO4消耗的是OH-;B中加入氯水后红色褪去,可能是氯水直接和OH-反应。C中加入BaCl2后产生白色BaSO3沉淀,可见原体系中含有SO32-
(4)①<;
通过砖红色的Cu2Y可判断出Y是O元素(葡萄糖与菲林试剂反应生成砖红色的氧化亚铜Cu2O沉淀)
②Cu2O+6HNO3===2Cu(NO3)2+2NO2↑+3H2O
(5)温度越高,平衡常数越小。
因为从表格数据得知,D物质的量为0,平衡一定会向正方向移动,(气体体积减小)而从题干信息得知,压强升高,在恒容绝热下那一定是因为放热导致容器温度升高,从而使得压强增大,推出正方向放热。
知识点
根据右图,可判断出下列离子方程式中错误的是
正确答案
解析
如图原电池中,Cd为负极,其电极总反就式为Co2+(aq)+Cd(s)==Co(s)+Cd2+(aq),B项研确;右图原电池中,Co为负极,其电极总反就式为2Ag+(aq)+Co(s)==2Ag(s)+Co2+(aq),D项正确。再由B、D两式可得,氧化性为Ag+ >Co2+>Cd2+,因此可得
2Ag+(aq)+Cd(s)==2Ag(s)+Cd2+(aq),故C项也正确;氧化性为Ag+>Cd2+,所以A项方程式的反应不能发生,A错。
知识点
扫码查看完整答案与解析