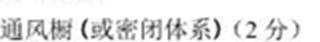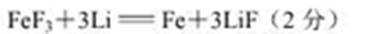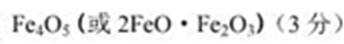- 化学基本概念和基本理论
- 共1765题
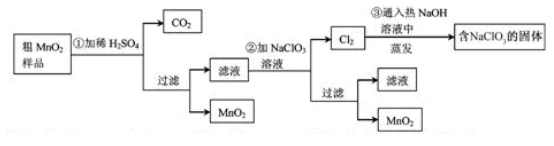
MnO

(1)第①步加稀H
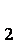
(2)第②步反应的离子方程式是__ _______+__ClO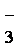
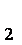

(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、_______、_______、_______,已知蒸发得到的固体中有NaClO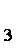
(4)若粗MnO
正确答案
(1)MnO2和MnCO3
(2)5Mn2++2ClO3-+4H2O=5MnO2↓+Cl2↑+8H+
(3)蒸发皿、酒精灯、玻璃棒;NaCl
(4)0.02
解析
本题综合考查离子反应方程式书写、氧化还原反应配平、化学计算以及化学实验的相关知识。情景简单,工艺流程清晰。
知识点
氯气在298K、100kPa时,在1L水中可溶解0.09mol,实验测得溶于水的Cl2约有三分之一与水反应。请回答下列问题:
(1)该反应的离子方程式为__________;
(2)估算该反应的平衡常数__________(列式计算)
(3)在上述平衡体系中加入少量NaOH固体,平衡将向__________移动;
(4)如果增大氯气的压强,氯气在水中的溶解度将__________(填“增大”、“减小”或“不变”),平衡将向__________移动。
正确答案
(1)
(2)
C起 0.09 0 0 0
C变 0.09×
C平 0.06 0.03 0.03 0.03

(3)正反应方向;
(4)增大,正反应方向
解析
略。
知识点
能正确表示下列反应的离子方程式为( )
正确答案
解析
A中反应还应该有CaCO3生成, C中还有BaSO4生成,故A、C错;B中因为ClO- 具有强氧化性,故正确;D中的产物、元素、电荷都守恒,正确。
知识点
下列反应中,可用离子方程式H++OH-=H2O表示的是
正确答案
解析
略
知识点
下列离子方程式错误的是( )
正确答案
解析
略
知识点
化学反应原理在科研和生产中有广泛应用
(1)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应
TaS2(s)+2I2(g)
反应(I)的平衡常数表达式K= ,若K=1,向某恒容密闭容器中加入1mol I2(g)和足量TaS2(s),I2(g)的平衡转化率为
(2)如图所示,反应(I)在石英真空管中进行,先在温度为T2的一端放入未提纯的TaS2粉末和少量I2(g),一段时间后,在温度为T1的一端得到了纯净的TaS2晶体,则温度T1 T2(填“﹥”“﹤”或“=”)。上述反应体系中循环使用的物质是 。
(3)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢铁中的硫转化为H2SO3,然后用一定浓度的I2溶液进行滴定,所用指示剂为 ,滴定反应的离子方程式为
(4)25℃时,H2SO3 
mol/L,若向NaHSO3溶液中加入少量的I2,则溶液中将 (填“增大”“减小”或“不变”)。
正确答案
(1)
(2)<,I2
(3)淀粉溶液,H2SO3+I2+H2O=4H++SO42-+2I-
(4)1.0×10-12,增大
解析
(1)
(2)由所给方程式可知该反应为吸热反应,通过题意温度T2端利于反应正向进行,为高温,温度T1端利于反应向左进行,为低温,所以T1<T2。I2是可以循环使用的物质。
(3)因为I2遇到淀粉会变蓝色,所以可以用淀粉溶液作指示剂.离子反应:H2SO3+I2+H2O=4H++SO42-+2I-.
(4)Ka=


知识点
Na2S2O3是重要的化工原料,易溶于水。在中性或碱性环境中稳定。
一,制备Na2S2O3•5H2O
反应原理:Na2SO3(aq)+S(s)
实验步骤:
① 称取15g Na2SO3加入圆底烧瓶中,再加入80ml蒸馏水。另取5g研细的硫粉,用3ml 乙醇润湿,加入上述溶液中。
② 安装实验装置(如图所示,部分加持装置略去),水浴加热,微沸60分钟。
③ 趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O3•5H2O,经过滤,洗涤,干燥,得到产品。
回答问题:
(1)硫粉在反应前用乙醇润湿的目的是 。
(2)仪器a的名称是 ,其作用是 。
(3)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是 ,检验是否存在该杂质的方法是 。
(4)该实验一般控制在碱性环境下进行,否则产品发黄,用离子方程式表示其原因:
。
二, 测定产品纯度
准确称取Wg产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000 mol•L‾1碘的标准溶液滴定。
反应原理为:2S2O32‾+I2=S4O62-+2I‾
(5)滴定至终点时,溶液颜色的变化: 。
(6)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为 mL。产品的纯度为(设Na2S2O3•5H2O相对分子质量为M) 。
三, Na2S2O3的应用
(7)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42‾,常用作脱氧剂,该反应的离子方程式为 。
正确答案
(1)使硫粉易于分散到溶液中
(2)冷凝管 冷凝回流
(3)
取少量产品溶于过量稀盐酸,过滤,向滤液中甲
(4)
(5)由无色变蓝色
(6)18.10
(7)
解析
略
知识点
19.下列反应的离子方程式正确的是
正确答案
解析
略
知识点
能正确表示下列反应的离子方程式是
正确答案
解析
考察离子方程式正误判断。A项,浓盐酸与铁屑反应生成Fe2+;B项,钠与CuSO4溶液反应,Na先与水反应,生成的NaOH再与硫酸铜反应;C项,是HCO3-与H+反应。
知识点
工业上制取冰晶石(Na3AlF6)的化学方程式如下:
2Al(OH)3+ 12HF+ 3Na2CO3=2Na3AlF6+ 3CO2↑+ 9H2O
根据题意完成下列填空:
(1)在上述反应的反应物和生成物中,属于非极性分子的电子式________,属于弱酸的电离方程式________。
(2)反应物中有两种元素在元素周期表中位置相邻,下列能判断它们的金属性或非金属性强弱的是________(选填编号)。
a. 气态氢化物的稳定性
b. 最高价氧化物对应水化物的酸性
c. 单质与氢气反应的难易
d. 单质与同浓度酸发生反应的快慢
(3)反应物中某些元素处于同一周期。它们最高价氧化物对应的水化物之间发生反应的离子方程式为________。
(4) Na2CO3俗称纯碱,属于________晶体。工业上制取纯碱的原料是________。
正确答案
(1)

(2)ac
(3)Al(OH)3+OH-=AlO2- +2H2O
(4)离子晶体;氯化钠;二氧化碳;氨
解析
(1)HF、H2O属于极性分子,CO2属于非极性分子;HF属于弱酸,Al(OH)3属于两性氢氧化物。
(2)O、F两种元素在周期表中位置相邻,由于二者均无最高价氧化物对应的水化物,且二者属于非金属,单质不与酸反应,故比较非金属性强弱的依据为a、c。
(3)Na与Al处于同一周期,由于Al(OH)3属于两性氢氧化物,因而它能与强碱氢氧化钠反应。
(4)碳酸钠属于离子晶体,工业常利用侯氏制碱法制备:①NaCl(饱和)+NH3+H2O+CO2=NH4Cl+NaHCO3↓ ②2NaHCO3(加热)=Na2CO3+H2O+CO2↑故常用原料为NaCl、NH3、CO2。
知识点
某种电池的正极材料,可通过下列方法制得:
①称取一定量的固体铁氧体磁性材料溶于过量盐酸,接着先后加入双氧水和氢氧化钠溶液,静
置24 h,过滤
②将沉淀加入反应瓶中,加入过量的氢氟酸溶液,80'c恒温加热24 ha
③蒸发多余氢氟酸和水,得淡红色FeF3凝胶
④在干燥箱中,以1000C预处理6 h,最后掺入铁氧体磁性材料混合研磨制得正极材料
(1)加入双氧水的作用是___(用离子方程式表示)
(2)步骤②的反应瓶材质可能是___(填序号)
A.玻璃 B.陶瓷 C.聚四氟乙烯
(3)加氢氟酸反生反应的化学方程式为____
(4)从安全的角度考虑,在实验室里制三氟化铁时应在____中进行
(5)三氟化铁与Li在固体电解质铁氧体中发生置换反应,产生的电流可供电脑使用,该电池反
应的化学方程式为____
(6)取上述铁氧体样品溶于足量盐酸,在通入标准状况下672 mL C12, Fe2+恰好被完全氧化成
Fe3十,然后把溶液蒸干,灼烧至恒重得9.6 g固体,则该铁氧体的化学式为____。
正确答案
(1)
(2)C(2分)
(3)
(4)
(5)
(6)
解析
略
知识点
在复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的反应的离子方程式是
正确答案
解析
根据离子反应的实质,可知发生的离子反应有①Fe3+ + 2OH-=Fe(OH)3↓②NH4+ + OH-=NH3·H2O③Ba2+ +2SO42-=BaSO4↓,且反应①优先发生于反应②。根据量的关系,可知A项二者物质的量之比为1:2时漏掉了反应①,B项为二者物质的量之比为1:2的反应,C项为二者物质的量之比为2:3的反应,此时还没有发生反应②,D项为二者物质的量之比为1:2,正确的写法为B项写法。
知识点
向等物质的量浓度的NaOH和Na2CO3的混合液中加入稀盐酸。下列离子方程式与事实不相符的是
正确答案
解析
略
知识点
根据废水中所含有害物质的不同,工业上有多种废水的处理方法。
(1)①废水I若采用CO2处理,离子方程式是_______。
②废水Ⅱ常用明矾处理。实践中发现废水中的c(HCO3-)越大,净水效果越好,这是因为_______。
③废水III中的汞元素存在如下转化(在空格上填相应的化学式):Hg2++_______=CH3Hg++H+我国规定,Hg2+的排放标准不能超过0.05 mg/L。若某工厂排放的废水1 L中含Hg2+3×10-17mo1,是否达到了排放标准_______(填“是”或“否”)。
④废水Ⅳ常用C12氧化CN—成CO2和N2,若参加反应的C12与CN—的物质的量之比为5:2,则该反应的离子方程式为_______。
(2)化学需氧量(COD)可量度水体受有机物污染的程度,它是指在一定条件下,用强氧化剂处理水样时所消耗的氧化剂的量,换算成氧的含量(以mg/L计)。某研究性学习小组测定某水样的化学需氧量(COD),过程如下:
I,取V1mL水样于锥形瓶,加入10.00 mL 0.2500 mol·L-1 K2Cr2O7溶液。
II,加碎瓷片少许,然后慢慢加入硫酸酸化,混合均匀,加热。
III,反应完毕后,冷却,加指示剂,用c mol·L-1的硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液滴定。终点时消耗硫酸亚铁铵溶液V2 mL。
①I中,量取K2Cr2O7,溶液的仪器是_______。
②III中,发生的反应为:Cr2O72-+6Fe2++14 H+=2Cr3++6Fe3++7H2O,由此可知,该水样的化学需氧量COD=_______(用含c、V1、V2的表达式表示)。
正确答案
(1)①OH-+CO2=HCO3-
②HCO3-会促进Al3+的水解,生成更多的Al(OH)3,净水效果增强
③CH4;是
④5 Cl2+2CN-+4H2O;10Cl-+2CO2+N2+8H+
(2)①酸式滴定管(或移液管);②
解析
(1)①据题意知废水I呈碱性,因此OH-+CO2=HCO3-,溶液的pH接近7。②HCO3-与铝离子发生相互促进的水解反应,使得产生更多的氢氧化铝沉淀。③利用元素守恒可知反应物为甲烷,
(2)①K2Cr2O7具有强氧化性应该用酸式滴定管或是移液管。②Cr2O72-+6Fe2++14 H+=2Cr3++6Fe3++7H2O,水样中的Cr2O72-为cV2×10-3×



知识点
能正确表示下列反应的离子方程式是
正确答案
解析
A选项,方程式未配平;B选项,碳酸锌不溶于水;C选项,该反应为可逆反应。
知识点
扫码查看完整答案与解析