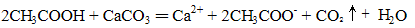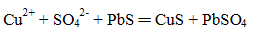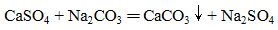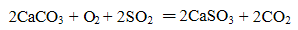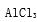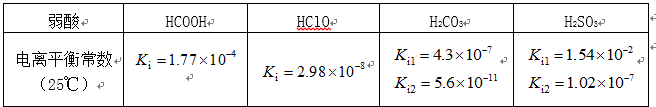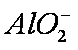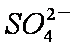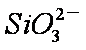- 化学基本概念和基本理论
- 共1765题
下列化学(或离子)方程式不正确的是
正确答案
解析
略
知识点
下列离子方程式书写正确的是
正确答案
解析
略
知识点
下列解释事实的化学方程式或离子方程式不正确的是
正确答案
解析
略
知识点
下列解释事实的化学方程式或离子方程式,不正确的是
正确答案
解析
略
知识点
下列离子方程式书写正确的是 ( )
正确答案
解析
略
知识点
能正确表示下列反应的离子方程式是
正确答案
解析
略
知识点
废旧铅蓄电池的回收利用是发展循环经济的必经之路。其阴、阳极填充物(铅膏,主要含PbO、PbO2、PbSO4)是废旧铅蓄电池的主要部分,回收时所得黄丹(PbO)、碳酸铅可用于合成三盐基硫酸铅(组成可表示为3PbO·PbSO4·H2O),其工艺流程如下:
(1)用碳酸盐作转化剂,将铅膏中的硫酸铅转化为碳酸铅,写出转化反应方程式:
(2)滤液A能用来回收Na2SO4·10H2O,提取该晶体的主要步骤有____________、___________、过滤、洗涤、干燥;检验该晶体中阴离子的实验方法是________ ____。
(3)物质X是一种可循环使用的物质,其溶质主要是______________(填化学式),若X中残留的 
(4)生成三盐基硫酸铅的离子方程式为____________________。
(5)向铅膏浆液中加入Na2SO3溶液的目的是将其中的PbO2还原为PbO。若实验中所取铅膏的质量为47。8g,其中PbO2的质量分数为15%,则要将PbO2全部还原,至少需要加入______mL的0.5 mol/LNa2SO3溶液。
正确答案
(1)PbSO4(s)+


(2)蒸发浓缩 、冷却结晶 (2分) 取少量晶体溶于蒸馏水,然后用盐酸酸化,再滴BaCl2溶液,若出现白色沉淀,即证明该晶体中含有SO42- (2分)
(3)HNO3(2分) 浸出时部分铅离子生成PbSO4随浸出渣排出,降低PbSO4的产率(2分)
(4)4 PbSO4 + 6OH- =3 PbO•PbSO4•H2O + 3 SO42- + 2 H2O (3分)
(5) 60(3分)
解析
略
知识点
部分弱酸的电离平衡常数如下表:
(1)在温度相同时,各弱酸的Ki值与酸性的相对强弱的关系为:________________________。
(2)下列离子方程式正确的是
A,2ClO- + H2O + CO2 → 2HClO + CO32-
B,2HCOOH + CO32- → 2HCOO- + H2O + CO2↑
C,H2SO3 + 2HCOO- → 2HCOOH + SO32-
D,Cl2 + H2O+2CO32- → 2HCO3- + Cl- + ClO-
(3)常温下,pH=3的HCOOH溶液与pH=11的NaOH溶液等体积混合后,溶液中离子浓度由大到小的顺序为 。
亚硒酸(H2SeO3)也是一种二元弱酸,常温下是一种无色固体,易溶于水,有较强的氧化性。
(4)往亚硒酸溶液中不断通入SO2 会产生红褐色单质,写出该反应的化学方程式: 。
(5)将亚硒酸与30%的H2O2加热可制得硒酸(H2SeO4),反应方程式如下:
H2SeO3 + H2O2 → H2SeO4+H2O,下列说法中正确的是
A,H2O2既是氧化剂又是还原剂
B,H2O 既不是氧化产物又不是还原产物
C,H2SeO4既是氧化产物又是还原产物
D,氧化性:H2SeO3>H2SeO4
碲酸(H6TeO6)是一种很弱的酸,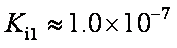
HI+ H6TeO6
(6)若反应中生成的TeO2与Te的物质的量之比为
正确答案
(1)Ki值越大,酸性越强
(2)BD
(3)C(HCOO—)>C(Na+)>C(H+)>C(OH—)
(4)H2SeO3 + 2SO2 +H2O → Se ↓+ 2H2SO4
(5)C
(6)8HI + 2H6TeO6 → TeO2 + Te +4I2 + 10H2O
解析
略
知识点
下列有关反应的化学方程式或离子方程式正确的是( )
正确答案
解析
略
知识点
下列条件下,离子能大量共存或者离子方程式正确的是
正确答案
解析
略
知识点
下列离子方程式书写正确的是
正确答案
解析
略
知识点
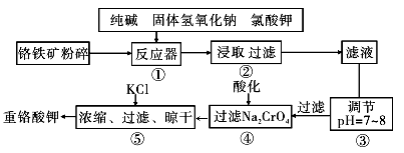
重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3,杂质为SiO2、Al2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下图。涉及的主要反应是: 6FeO·Cr2O3+24NaOH+7KClO3=12Na2CrO4+3Fe2O3+7KCl+12H2O。
(1)碱浸前将铬铁矿粉碎的目的是________。
(2)步骤③调节pH后过滤得到的滤渣是________。
(3)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式________。
(4)用简要的文字说明操作⑤加入KC1的原因________________。
(5)目前处理酸性Cr2O72-废水多采用铁氧磁体法。该法是向废水中加入FeSO4 ·7H2O将Cr2O72-还原成Cr3+,调节pH,Fe、Cr转化成相当于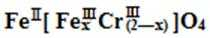
A. x =0.5 ,a =8
B. x =0.5 ,a = 10
C. x = 1.5 ,a =8
D. x = 1.5 ,a = 10
正确答案
(1)增大接触面积,增大反应速率。
(2)Al(OH)3;H2SiO3
(3)2CrO42-+2H+ 
(4)温度对氯化钠的溶解度影响小,但对重铬酸钾的溶解度影响较大,利用复分解反应可以得到重铬酸钾。
(5)D
解析
略。
知识点
下列离子方程式的书写正确的是
正确答案
解析
略
知识点
高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂。工业上可以通过次氯酸钠氧化法制备高铁酸钠,生产过程如下:
回答下列问题:
(1)氢氧化钠的电子式是________。
(2)经过步骤①后,加入NaOH固体的原因是________。
(3)步骤②反应的离子方程式是________。
(4)从溶液Ⅰ中分离出Na2FeO4后,还有副产品Na2SO4 、NaCl,则步骤③中反应的离子方程式为________。
(5)将一定量的Na2FeO4投入到pH不同的污水中(污水中其余成分均相同),溶液中Na2FeO4浓度变化如下图曲线Ⅰ、Ⅱ所示,试推测曲线I比曲线II对应的污水pH
________(填“高”或“低”)。
(6)通过计算得知Na2FeO4的消毒效率(以单位质量得到的电子数表示)比氯气的_____(填“高”或“低”),用高铁酸钠代替氯气作净水消毒剂的优点是_____(答出两点即可)。
正确答案
见解析。
解析
(1)
(2)Na2FeO4只在碱性环境中稳定存在,所以加入氢氧化钠可以调节溶液显碱性
(3)2Fe2+ + H2O2 + 2H+ = 2Fe3+ + 2H2O
(4)2Fe3+ + 3ClO- + 10OH- = 2FeO42- + 3Cl- + 5H2O
(5)高
(6)低 , 既能消毒杀菌又能净水(或无毒或方便保存等)
知识点
根据下表提供的数据,下列判断正确的是
正确答案
解析
略
知识点
扫码查看完整答案与解析