- 物质的分离、提纯和检验
- 共229题
强电解质甲、乙、丙、丁分别溶于水,电离出NH4+、Ba2+、Mg2+、H+、OH-、Cl-、HCO3-、SO42-(每种溶液中溶质电离出的离子各不相同)。已知:① 甲溶液分别与其它三种溶液混合,均产生白色沉淀;② 0.1 mol·L-1乙溶液中c(H+)>0.1 mol·L-1;③ 向丙溶液中滴入AgNO3溶液,产生不溶于稀HNO3的白色沉淀。下列结论不正确的是
正确答案
解析
略
知识点
学习小组设计了如下图实验(部分装置),将氯气依次通过下列装置以验证氯气的性质:
(1)通入氯气后,a中的现象是 。
c装置中发生反应的离子方程式为: 。
(2)d装置的所发生反应的离子方程式
(3)通入氯气一段时间后,洗气瓶B溶液中有一部分SO32-氧化成SO42-。设计试验方案,
检验洗气瓶B溶液中Cl-和SO42-的存在。在答题卡上补充填写出实验步骤、预期现象
和结论。(可填满也可不填满)限选试剂及仪器:2 mol/LHCl、2 mol/LHNO3、1 mol/LBaCl2溶液、l mol/LBa(NO3)2溶液、0.1 mol/LAgNO3溶液、澄清石灰水、试管、胶头滴管。
(4)上述实验需要100mL,2mol/L的HCl,配制时量筒量取36.5%,密度1.19g/mL的浓盐酸的体积为 mL
正确答案
(1)溶液变蓝色,(2分)2Fe2++Cl2== 2Fe3++2Cl-(2分)
(2)Cl2 + 2OH- = Cl- + ClO- + H2O(2分)
(3)(8分)(合理即给分)
(若在步骤2中:先加足量2 mol/L HNO3,再滴加入过量l mol/LBa(NO3)2溶液,(1分)振荡,静置。
则在步骤3中就不需要再加入过量的2 mol/L HNO3。)
(4)16.8mL(2分)
解析
略
知识点
甲、乙、丙、丁四种易溶于水的物质,分别由NH4+、Ba2+、Mg2+、H+、OH-、Cl-、HCO3-、SO42-中的不同阳离子和阴离子各一种组成。已知:①将甲溶液分别与其它三种物质的溶液混合,均有白色沉淀生成;②0.1mol/L乙溶液中c(H+)>0.1mol/L;③向丙溶液中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成。下列结论不正确的是( )
正确答案
解析
略
知识点
某无色溶液可能含有①Na+ ②Ba2 + ③Cl一 ④Br一 ⑤SO32一 ⑥SO42一中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
下列结论正确的是
正确答案
解析
略
知识点
某未知溶液可能含Cl-、CO32-、Na+、SO42-、Al3+。将溶液滴在蓝色石蕊试纸上,试纸变红。取少量试液,滴加硝酸酸化的氯化钡溶液,有白色沉淀生成;在上层清液中滴加硝酸银溶液,产生白色沉淀。下列判断合理的是
正确答案
解析
略
知识点
有一固体混合物,可能含有FeCl2、NaNO2、Ba(OH)2、A1C13、Na2SO3中的若干种。取适量该混合物加适量水充分搅拌,得到白色沉淀A与无色溶液B。
①取少量A加入稀硝酸至过量,白色沉淀部分溶解
②取少量B逐滴加入稀硫酸至过量,不断生成白色沉淀后沉淀部分溶解
③取少量B滴加少量酸性高锰酸钾,振荡,最终得无色溶液
根据上述实验现象,以下推测正确的是 ( )
正确答案
解析
略
知识点
25℃时,某溶液中含有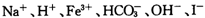
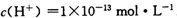
正确答案
解析
略
知识点
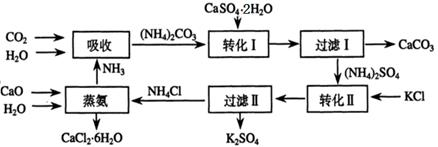
将磷肥生产中形成的副产物石膏(CaSO4·2H2O)转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义。以下是石膏转化为硫酸钾和氯化钙的工艺流程示意图。
(1)本工艺中所用的原料除CaSO4·2H2O、KCl外,还需要_________等原料。
(2)石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式为_________。
(3)过滤Ⅰ操作所得固体中,除CaCO3外还含有_________(填化学式)等物质,该固体可用作生产水泥的原料。
(4)检验过滤Ⅰ所得滤液中含有CO32-的方法是_________。
(5)氯化钙结晶水合物(CaCl2·6H2O)是目前常用的无机储热材料,选择的依据是_________。
a. 熔点较低(29℃熔化)
b. 能导电
c. 能制冷
d. 无毒
(6)上述工艺流程中体现绿色化学理念的是_________。
正确答案
(1)CaCO3 NH3 H2O
(2)CaSO4+CO32-=CaCO3+SO42-
(3)CaSO4
(4)滤液中滴加盐酸产生气泡
(5)ad
(6)碳酸钙用于制水泥原料、硫酸钙和氯化钾转化为硫酸钾和氯化钙、氨在工艺中循环使用等(原子利用率高,没有有害物质排放到环境中)
解析
略。
知识点
某工业废水仅含下表中的某些离子,且各种离子的物质的量浓度相等,均为0.1mol/L(此数值忽略水的电离及离子的水解)。
甲同学欲探究废水的组成,进行了如下实验:
Ⅰ、取该无色溶液5 mL,滴加一滴氨水有沉淀生成,且离子种类增加。
Ⅱ、用铂丝蘸取溶液,在火焰上灼烧,透过蓝色钴玻璃观察,无紫色火焰。
Ⅲ、另取溶液加入过量盐酸,有无色气体生成,该无色气体遇空气变成红棕色。
Ⅳ、向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)由I、Ⅱ判断,溶液中一定不含有的阳离子是 。
(2)Ⅲ中加入盐酸生成无色气体的离子方程式是 。
(3)甲同学最终确定原溶液中所含阳离子有 ,阴离子有 ;并据此推测原溶液应该呈 性,原因是 (请用离子方程式说明)。
(4)另取100 mL原溶液,加入足量的NaOH溶液,此过程中涉及的离子方程式为
。充分反应后过滤,洗涤,灼烧沉淀至恒重,得到的固体质量为 g。
正确答案
(1)
(2)
(3)Mg2+、Al3+;
(4)
解析
略
知识点
9.(NH4)2SO4是常见的化肥和化工原料,受热易分解。某兴趣小组拟探究其分解产物。
[查阅资料] (NH4)2SO4在2600C和4000C时分解产物不同。
[实验探究]该小组拟选用下图所示装置进行实验(夹持和加热装置略)
实验1:连接装置A-B-C-D,检查气密性,按图示加入试剂(装置B盛0.5000mol/L盐酸70.00mL)。通入N2排尽空气后,于2600C加热装置A一段时间,停止加热,冷却,停止通入N2。品红溶液不褪色,去下装置B,加入指示剂,用0.2000mol/LNaOH溶液滴定剩余盐酸,终点时消耗NaOH溶液25.00Ml。经检验滴定后的溶液中无SO42-.
(1)仪器X的名称是________________.
(2)滴定前,下列操作的正确顺序是_________(填字母编号)。
a. 盛装0.2000mol/LNaOH溶液
b. 用0.2000mol/LNaOH溶液润洗
c. 读数、记录
d. 查漏、清洗
e. 排尽滴定管尖嘴的气泡并调整液面
(3)装置B内溶液吸收气体的物质的量是__________mol
实验2:连接装置A-D-B,检查气密性,按图示重新加入试剂。通入N2排尽空气后,与4000C加热装置A至(NH4)2SO4完全分解无残留物,停止加热,冷却,停止通入N2.观察到装置A、D之间的导气管内有少量白色固体。经检验,该白色固体和装置D内溶液中有SO32-,无SO42。进一步研究发现,气体产物中无氮氧化物。
(4)检验装置D内溶液中有SO32-,无SO42-的实验操作和现象是__________.
(5)装置B内溶液吸收的气体是____________.
(6)(NH4)2SO4在4000C分解的化学方程式是______________________.
正确答案
(1)圆底烧瓶
(2)dbaec
(3)0.03
(4)取少量装置D内溶液于试管中,滴加BaCl2溶液,生成白色沉淀;加入足量稀盐酸后沉淀完全溶解,放出无色刺激性气体
(5)NH3或氨气
(6)3(NH4)2SO4
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析