- 复杂化学式的确定
- 共54题
interrupt
正确答案
5.下列关于合成材料的说法中,不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
6.设NA为阿伏加德罗常数的值。下列有关叙述中正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
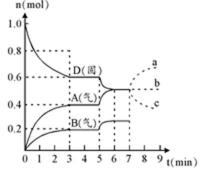
25.在容积为2.0 L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,据图回答下列问题:
(1)从反应开始到第一次达到平衡时,A物质的平均反应速率为____________mol/L·min。
(2)根据上图写出该反应的化学方程式________________________,该反应的平衡常数表达式为K =____________________。
(3)第5分钟时,升高温度,A、B、D的物质的量变化如右图,则该反应的正反应是_________(填“放热”或“吸热”)反应,反应的平衡常数_________(填“增大”、“减小”或“不变”。下同),B的反应速率_________。
(4)若在第7分钟时增加D的物质的量,A的物质的量变化正确的是______(用图中a、b、 c的编号回答)
正确答案
(1)0.067
(2)2D(s) 
(3)吸热 ;增大;增大
(4)b
解析
解析已在路上飞奔,马上就到!
知识点
12.利用“化学蒸气转移法”制备TaS2晶体,发生如下反应
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
29.I.氨是氮循环中的重要物质,在生产、生活和科研中有着广泛的应用。
一定条件下,将2molNH3和1molCO2充入容积为2L的密闭容器中发生反应2NH3(g)+CO2

II.在一固定体积的密闭容器中,在850℃时发生如下反应:
容器内各物质的浓度(mol/L)变化如下(在850℃时其化学平衡常数K=1.0)。
(1)下列可以作为判断该反应已经达到化学平衡状态依据的是_________________。
A.容器内压强不变
B.CO的消耗速率等于CO2的生成速率
C.混合气体中CO的体积分数不变
D.c(CO2):c(H2)=1:l
(2)上表中:cl=_____________mol/L。
III.若在25℃时,pH=a的氢氧化钠溶液与pH=b的醋酸溶液等体积混合,恰好完全反应。
(1)混合液中A-水解常数的表达式为Kh=__________________________。
(2)计算该温度下醋酸的电离常数(用含a、b的式子表示)为________________。
正确答案
II.C 0.08
III.
解析
解析已在路上飞奔,马上就到!
知识点
10.铁氧体(Fe3O4)法是处理含铬废水的常用方法,其原理是:用FeSO4把废水中Cr2O还原为Cr3+,并通过调节废水的pH,使生成物组成符合类似于铁氧体(Fe3O4或Fe2O3·FeO)的复合氧化物(x2-xO3·O)。处理含1 mol Cr2O废水至少需要加入a mol FeSO4·7H2O。下列结论正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
10.关于沉淀溶解平衡和溶度积常数,下列说法不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
26.某学习小组利用如图实验装置制备Cu(NH3)xSO4·H2O,并测量x值。
【Cu(NH3)xSO4·H2O制备】见图1
(1)A中发生的化学反应方程式为 。
(2)C中CCl4的作用是 。
(3)B中先产生蓝色沉淀,随后沉淀溶解变成深蓝色溶液,此溶液中含有Cu(NH3)xSO4,若往此溶液中加入过量稀硫酸,溶液颜色由深蓝色变为浅蓝色,结合化学平衡移动原理分析其原因: 。
【x值的测量】见图2
步骤一:检查装置气密性,称取0.4690 g晶体于锥形瓶a中
步骤二:通过分液漏斗向锥形瓶a中滴加l0% NaOH溶液至无气体产生为止
步骤三:用0.5000 mol/L的NaOH标准溶液液滴定b中剩余HCl,消耗标准溶液液16.00 mL
(4)步骤二的反应可理解为Cu(NH3)xSO4与NaOH在溶液中反应,其离子方程式为: 。
【x值的计算与论证】
(5)计算:x = 。该学习小组针对上述实验步骤,提出测量值(x)比理论值偏小的原因如下:
假设1:步骤一中用于称量的天平砝码腐蚀缺损;
假设2:步骤二中______________________________________________(任写两点);
假设3 :步骤三中测定结束读数时,体积读数偏小。该假设_____(填“成立”或“不成立”)。
(6)针对假设1,你对实验的处理改进意见是____________________________________。
正确答案
(1)Ca(OH)2+2NH4Cl
(2)防止倒吸
(3)

(4)Cu(NH3)x2+ + 2OH- = Cu(OH)2↓+ xNH3↑
(5)3.56 加入的NaOH溶液不足、没有加热、生成的氨气未完全逸出、NaOH溶液浓度过低等 不成立
(6)更换砝码完好的托盘天平后,重新进行步骤一到步骤三的全部实验
解析
解析已在路上飞奔,马上就到!
知识点
28.碱式碳酸盐A可用作胃药,其组成可表示为Al2Mg6(0H)x(C03)y.zH20。某校化 学兴趣小组欲测定其化学式,实验设计如下:
实验I:称取一定质量的A,加热分解至恒重。
实验II:称取一定质量的A,与足量的酸反应,测量生成CO2气体的质量。
可供选择的仪器和药品如图所示:(酸溶液限选6mol.L_1 HCl或6mol.L_1 H2SO4,其它 试剂任选。)
回答下列问题:
(1)仪器乙的名称为________。
(2)请选择必要的装置完成实验II,正确的连接顺序为________ (按气流方向,用接口字母表示);选用的酸溶液是________。
(3)有人提出不采用实验I,可在实验II结束后,在A完全反应后所得溶液中滴加足 量的氨水,用无灰滤纸过滤,用蒸馏水洗涤反应容器2〜3次,将洗涤液过滤,洗涤 沉淀2〜3次,将附着沉淀的滤纸放到坩埚中加热分解至恒重。判断沉淀已洗涤干净的方法是_________________,实际上未采用该方案的原因是不符合实验设计的________原则(填字母编号)。
A. 科学性
B.安全性
C.可行性
D.简约性
(4)x与y的关系式是________(用等式表示)。
(5)通过实验I的相关数据,经计算可得A的摩尔质量为602.0g.mol-1。实验II中称得 样品A的质量为9.030g,与足量酸完全反应后,CO2吸收装置增重0.660g,则A 的化学式为________
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析