- 钠的重要化合物
- 共64题
3.0.1mol下列气体分别与1L 0.l mol·L-1的NaOH溶液反应,形成的溶液pH最小的是
正确答案
解析
A.NO2与NaOH恰好完全反应: 2NO2+2NaOH=NaNO2+NaNO3+H2O,常温下生成的NaNO2水解而显碱性,pH>7; B.SO2 与NaOH恰好完全反应:SO2 +NaOH=NaHSO3,常温下生成的NaHSO3电离强于水解而显酸性,pH<7; C.SO3 与NaOH恰好完全反应:SO3 +NaOH=NaHSO4,常温下生成的NaHSO4电离强于水解、且比NaHSO3的电离程度更大,故酸性更强,pH更小——在四个选项中最小; D.CO2与NaOH恰好完全反应:CO2+NaOH= NaHCO3,常温下生成的NaHCO3水解强于电离而显碱性,pH>7。
考查方向
解题思路
通过这些非金属氧化物或酸性氧化物与碱的1:1的反应结果判断。
易错点
对二氧化氮与NaOH的反应不熟悉,以及NaHSO3电离强于水解而显酸性。
知识点
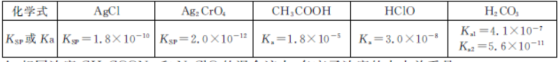
6.下表是25°C时某些盐的浓度积常数和弱酸的电离平衡常数,下列说法正确的是 ( )[来源:学。科。网Z。X。X。K]
正确答案
解析
A.次氯酸根离子的水解程度大于醋酸根离子,所以c(CH3COO-)>c(ClO-),故A错误;B.HClO的电离平衡常数大于HCO3-,所以次氯酸的酸性大于碳酸氢根离子,则碳酸钠和少量氯水反应的离子方程式为:CO32-+Cl2+H2O═HCO3-+Cl-+H++ClO-,故B正确;C.缓冲溶液中pH=pKa+lg[(弱酸盐)/(弱酸)=4.8+lg(5/9)≈4.5,故C错误D.混合溶液中生成氯化银需要的c(Ag+)=[Ksp(AgCl)]/c(Cl-)=1.8×10-7mol/L,生成Ag2CrO4需要的c(Ag+)=[Ksp(AgCl)/c(Cl-)]1/2=4.47×10-5mol/L,所以氯离子先生成沉淀,故D错误;
考查方向
解题思路
A.次氯酸根离子的水解程度大于醋酸根离子,所以c(CH3COO-)>c(ClO-);B.弱电解质的电离平衡常数越大,其酸性越强,所以次氯酸比碳酸氢根离子的酸性强;C.混合溶液中pH=pKa+lg[(弱酸盐)/(弱酸) D.混合溶液中生成氯化银需要的c(Ag+)=[Ksp(AgCl)]/c(Cl-),生成Ag2CrO4需要的c(Ag+)=[Ksp(AgCl)/c(Cl-)]1/2;
易错点
A.不理解Ka越大,则酸性越强,对应的酸根离子水解程度越小,离子浓度越大;B.不能正确判断强弱酸的反应关系;C.不能熟练进行pH计算;D.不能准确判断Ksp与离子先后沉淀的关系。
知识点
19.常温下,用0.1000 mol•L-1 NaOH溶液滴定20.00mL0.1000 mol•L-1 CH3COOH溶液所得滴定曲线如右图,下列说法不正确的是
正确答案
解析
A.在点③时, NaOH溶液和CH3COOH溶液的等体积、等浓度混合,溶液中含有的物质的量相等,等物质的量的醋酸和氢氧化钠恰好反应生成强碱弱酸盐醋酸钠,弱酸根醋酸根离子水解导致其溶液呈碱性;CH3COO-+H2O
考查方向
解题思路
A.点③时, NaOH溶液和CH3COOH溶液的体积均为20mL,而且浓度也相等,所以溶液中含有的物质的量也就相等,等物质的量的醋酸和氢氧化钠恰好反应生成醋酸钠,醋酸钠是强碱弱酸盐,弱酸根离子水解导致其溶液呈碱性;B.点②时溶液的pH=7,根据电荷守恒:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),由于c(OH-)=c(H+),所以溶液中c(Na+)=c(CH3COO-)。C.点①溶液中NaOH溶液不足,反应后剩余的CH3COOH的物质的量为0.001mol,反应生成的CH3COONa也为0.001mol,此时溶液呈酸性,c(CH3COOH)>c(Na+),c(CH3COOH)+c(H+)>c(CH3COO-)+c(OH-)D.酸或碱对水的电离产生抑制作用,而能水解的盐对水的电离产生促进作用,在逐滴加入NaOH溶液的过程中,CH3COOH逐渐被NaOH中和,所以对水的电离的抑制程度减弱,当NaOH过量后,水的电离程度又逐渐减小。
易错点
不能准确提取图中信息,不会利用电荷守恒解决等量和大小关系。
知识点
1.下列物质直接参与的反应与氧化还原反应无关的是
正确答案
解析
A.维生素C具有还原性,可以防止二价铁元素被氧化,用作贫血患者补铁剂的搭档,错误;
B.二氧化硫与生石灰结合生成亚硫酸钙,与氧化还原反应无关,正确;
C.三价铁离子有氧化性,可与金属铜反应,氯化铁溶液可用于腐蚀印刷电路板,错误;
D.高铁酸盐中铁元素化合价为+6价,具有强氧化性,所以可用于杀菌、消毒,错误;故选B。
考查方向
解题思路
A.维生素C具有还原性,可以防止二价铁元素被氧化;
B.二氧化硫与生石灰结合生成亚硫酸钙,与氧化还原反应无关;
C.三价铁离子有氧化性,可与金属铜反应;
D.高铁酸盐中铁元素化合价为+6价,具有强氧化性;
易错点
高铁酸盐中铁元素化合价为+6价,具有强氧化性;
知识点
11.向0.1 mol / L CH3COOH溶液中加入CH3COONa晶体或加水稀释时,都会引起
正确答案
解析
CH3COOH电离平衡中,加CH3COONa晶体,会抑制醋酸的电离(故B错误),c(H+)减小,c(OH-)增大(故D.错误)pH增大;且CH3COONa是强电解质,溶液中自由离子的浓度增大,导电能力增强(故C.错误);或加水稀释,促进醋酸的电离,但是溶液中c(H+)减小,则c(OH-)增大,pH增大,故A.正确。
考查方向
解题思路
CH3COOH电离平衡的移动原理。
易错点
B.CH3COOH的电离程度增大。
知识点
扫码查看完整答案与解析