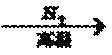- 化学科学与探究
- 共412题
16. 研究大气中含硫化合物(主要是SO2和H2S)的转化具有重要意义。
(1)高湿条件下,写出大气中SO2转化为HSO3-的方程式:_____________。
(2)土壤中的微生物可将大气中H2S经两步反应氧化成SO42-,两步反应的能量变化示意图如下:
1mol H2S(g)全部氧化成SO42-(aq)的热化学方程式为______________________。
(3)二氧化硫—空气质子交换膜燃料电池可以利用大气所含SO2快速启动,其装置示意图如下:
①质子的流动方向为___________(“从A到B”或“从B到A”)。
②负极的电极反应式为______________________ 。
(4)燃煤烟气的脱硫减排是减少大气中含硫化合物污染的关键。SO2烟气脱除的一种工业流程如下:
①用纯碱溶液吸收SO2将其转化为HSO3-,反应的离子方程式是______________________。
②若石灰乳过量,将其产物再排回吸收池,其中可用于吸收SO2的物质的化学式是___________。
正确答案
(1)SO2 + H2O 

(2)H2S(g) + 2O2(g) = SO42-(aq) + 2H+(aq) ΔH = -806.39 kJ·mol-1
(3)①从A到B ② SO2 – 2e- + 2H2O == SO42- + 4H+
(4)① H2O + 2SO2 + CO32- == 2HSO3- + CO2↑ ② NaOH [多写Ca(OH)2不扣分]
解析
(1)高湿条件下SO2转化为HSO3-的过程即为SO2与水反应生成H2SO3;SO2 + H2O 

由两步反应的能量变化示意可以看出,H2S先被氧化为S(g)释放能量,H2S(g)+0.5O2(g)===S(g)+H2O(g) ΔH = -221.19 kJ·mol-1,然后再S被进一步氧化为 SO42-(aq)释放能量:S(g)+1.5O2(g)+H2O(g)===SO42-(aq) + 2H+(aq) ΔH = -585.20 kJ·mol-1,所以1mol H2S(g)全部氧化成SO42-(aq)的热化学方程式就可以根据盖斯定律完成;将两个热方程式相加:H2S(g) + 2O2(g) = SO42-(aq) + 2H+(aq) ΔH = -806.39 kJ·mol-1
(3)①由于该装置为原电池,且SO2为还原剂失去电子作负极,O2氧化剂得到电子作正极,而质子带正电荷,在原电池中带正电荷的阳离子向正极移动;所以质子的流动方向为从A到B;②由于SO2作负极失去电子,在溶液中一定会生成SO42-,即电极反应式为: SO2 – 2e- + 2H2O == SO42- + 4H+
(4)①由于H2SO3酸性比H2CO3酸性强,所以用纯碱溶液吸收SO2,H2SO3可以将纯碱转化为 CO2, 反应的离子方程式为:H2O + 2SO2 + CO32- == 2HSO3- + CO2↑;②若石灰乳过量,则其产物中有生成的NaOH ,所以再排回吸收池,其中可用于吸收SO2的物质的物质就为NaOH 。
考查方向
通过大气中含硫化合物的转化过程,考查弱电解质的电离平衡、热方程式的书写、电极反应、离子方程式的书写、尾气的处理等中学化学主干知识。
解题思路
(1)高湿条件下SO2转化为HSO3-的过程即为SO2与水反应生成H2SO3,然后再发生电离;
由两步反应的能量变化示意可以看出,H2S(g)先被氧化为S(g)释放能量,
(2)然后再被进一步氧化为 SO42-(aq)释放能量,所以1mol H2S(g)全部氧化成SO42-(aq)的热化学方程式就可以根据盖斯定律完成;
(3)由于该装置为原电池,且SO2为还原剂失去电子作负极,O2氧化剂得到电子作正极,而质子带正电荷,在原电池中带正电荷的阳离子向正极移动;由于SO2作负极失去电子,在溶液中一定会生成SO42-
(4)由于H2SO3酸性比H2CO3酸性强,所以用纯碱溶液吸收SO2,H2SO3可以将纯碱转化为 CO2,若石灰乳过量,则其产物中有生成的NaOH ,所以再排回吸收池,其中可用于吸收SO2的物质的物质就为NaOH。
易错点
多元弱酸的分步电离;书写热方程式要注意物质状态以及焓变值要与系数对应;电极反应、离子方程式的书写都要遵循守恒规律。
知识点
16.以电石渣[主要成分为Ca(OH)2和CaCO3]为原料制备KClO3的流程如下:
(1)氯化过程控制电石渣过量,在75℃左右进行。氯化时存在Cl2与Ca(OH)2作用生成Ca(ClO)2的反应,Ca(ClO)2进一步转化为Ca(ClO3)2,少量Ca(ClO)2 分解为CaCl2和O2。
①生成Ca(ClO)2的化学方程式为 ▲ 。
②提高Cl2转化为Ca(ClO3)2的转化率的可行措施有 ▲ (填序号)。A.适当减缓通入Cl2速率 B.充分搅拌浆料 C.加水使Ca(OH)2完全溶解
(2)氯化过程中Cl2 转化为Ca(ClO3)2的总反应方程式为
6Ca(OH)2+6Cl2=Ca(ClO3)2+5CaCl2+6H2O
氯化完成后过滤。

②滤液中Ca(ClO3)2与CaCl2的物质的量之比
n[Ca(ClO3)2] ∶n[CaCl2] ▲ 1∶5
(填“>”、“<”或“=”)。
(3)向滤液中加入稍过量KCl固体可将Ca(ClO3)2转化为
KClO3,若溶液中KClO3的含量为100g▪L-1,从该溶液中
尽可能多地析出KClO3固体的方法是 ▲ 。
正确答案
(1)①2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O;②AB (2)①CaCO3、Ca(OH)2 ②<;
(3)蒸发浓缩、冷却结晶
知识点
14.单质Z是一种常见的半导体材料,可由X通过如下图所示的路线制备,其中X为Z的氧化物,Y为氢化物,分子结构与甲烷相似,回答下列问题:
(1)能与X发生化学反应的酸是 ;由X制备Mg2Z的化学方程式为 。
(2)由Mg2Z生成Y的化学反应方程式为 ,Y分子的电子式为 。
(3)Z.X中共价键的类型分别是 。
正确答案
(1)氢氟酸;SiO2+MgO2↑+Mg2Si;
(2)Mg2Si+4HCl=2 MgCl2+SiH4;
(3)非极性键、极性键
知识点
2.下列说法不正确的是( )
正确答案
解析
A、CH3CH2OH中含有三种氢,CH3OCH3 结构对称,只含有一种氢,故可用核磁共振氢谱区分CH3CH2OH和CH3OCH3 ,所以A错误;
B.苯酚与溴水反应中溴水要褪色且产生白色沉淀,而2,4-已二烯与溴水发生加成反应溴水要褪色,而甲苯与溴水不反应,所以B 正确;
C、在室温下,丙三醇极易溶于水,苯酚室温下微溶于水,卤代烃均不溶于水;所以在水中的溶解度:甘油>苯酚>溴乙烷;所以C 正确;
D.两种二肽互为同分异构,水解产物可能是相同的氨基酸,如一分子甘氨酸和一分子丙氨酸形成的二肽中有两种构成方式,但二肽水解时的产物相同,所以D正确
考查方向
通过常见有机化合物的结构、鉴别方法、溶解性和同分异构体和水解产物的结构特点,考查有机化合物的结构和性质。
解题思路
A.在核磁共振氢谱图中,特征峰的数目反映了有机分子中氢原子化学环境的种类;不同特征峰的强度比(及特征峰的高度比)反映了不同化学环境氢原子的数目比。可以根据不同氢原子化学环境的种类和不同化学环境氢原子的数目来判断有机物的结构。
B.苯酚与溴水反应,溴水褪色产生白色沉淀,烯烃可与溴水发生加成反应而褪色,甲苯与溴水不反应;
C、丙三醇极易溶于水,苯酚室温下微溶于水,卤代烃均不溶于水;
D.两种二肽互为同分异构,水解产物可能是相同的氨基酸,如一分子甘氨酸和一分子丙氨酸形成的二肽中有两种构成方式,但二肽水解时的产物相同。
易错点
A.易将氢原子化学环境的种类和不同化学环境氢原子的数目比观察和判断错误;
B.苯酚与溴水反应中溴水要褪色且产生白色沉淀,而2,4-已二烯与溴水发生加成反应溴水要褪色,而甲苯与溴水不反应。
D.两种二肽互为同分异构,水解产物可能是相同的氨基酸,如一分子甘氨酸和一分子丙氨酸形成的二肽中有两种构成方式,但二肽水解时的产物相同。
知识点
7.下列叙述正确的是
正确答案
知识点
7.下列叙述正确的是
正确答案
解析
A.能与MnO2反应的是浓盐酸且还有加热,故稀盐酸不能除去烧瓶内残留的MnO2;B.因为NaOH溶液能与玻璃成分之一的SiO2反应生成具有粘性的硅酸钠,故不能用磨口玻璃瓶保存NaOH溶液;C.银能被稀硝酸氧化,故稀硝酸可除去试管内壁的银镜,为选项之一;D.自来水煮沸时,其中的Ca(HCO3)2受热分解为CaCO3沉淀,故煮沸自来水可除去其中的可溶性的Ca(HCO3)2,为选项之一。
考查方向
解题思路
依据物质的性质去筛选。
易错点
易漏选。
知识点
1.下列说法不正确的是
正确答案
知识点
9.在给定的条件下,下列选项所示的物质间转化均能实现的是
正确答案
解析
试题分析:A、SiO2与盐酸不反应,错误;B、SO2和H2O反应生成H2SO3,错误;C、N2+3H2
考查方向
解题思路
要熟悉常见物质之间的转化。
易错点
不清楚二氧化硅化学性质的特殊性:与盐酸不反应。
知识点
茶一般以茶树的顶芽和幼叶制成。请回答下列有关问题:
61.采茶主要集中在春、秋两季。随着采摘批次的增加,新梢的数量大大增加,从激素调节的角度看,原因是__________________ 。
62.茶树常采用扦插繁殖。研究小组为探究不同浓度三十烷醇(植物生长调节剂)对茶树插条生根的影响,完成了一组预实验,结果如图。
①该实验的自变量是____ ;从图中所示知道,此实验的对照有两大类:一是用___ 处理插条,作为空白对照;二是用 处理插条进行相互对照。
②从预实验的结果可知,三十烷醇浓度为15 ppm时对茶树插条生根具有_______ (填“抑制”、“促进”)作用。
③ 若要探究三十烷醇促进茶树插条生根的最适浓度,还应增设实验组,从图中数据判断,三十烷醇浓度的取值应设在________ppm。
④ 用三十烷醇处理茶树插条比较简便的方法有沾蘸法和浸泡法。与沾蘸法相比,浸泡法所用的浓度 ,所需处理时间______________。
正确答案
解除了顶端优势,促进了侧芽的生长发育
解析
随着采摘批次的增加,新梢的数量大大增加,是由于解除了顶端优势,促进了侧芽的生长发育。
考查方向
本题主要考查了解除顶端优势的相关知识,旨在考查学生分析题图获取信息的能力,理解所学知识的要点,把握知识的内在联系并应用相关知识结合题干信息对某些生物学问题进行解释、推理、判断的能力。
解题思路
结合知识分析题干完成
易错点
原因分析
正确答案
① 三十烷醇的浓度 三十烷醇浓度为0(或蒸馏水) 不同浓度的三十烷醇溶液
② 促进
③ 8~15
④ 较低 较长
解析
由图可知,自变量是三十烷醇的浓度,空白对照用三十烷醇浓度为0(或蒸馏水)处理插条,用不同浓度的三十烷醇溶液处理插条进行相互对照。三十烷醇浓度为0时,生根数为18.5,三十烷醇浓度为15 ppm时,生根数为23.0,所以此时浓度为促进作用;探究三十烷醇促进茶树插条生根的最适浓度,三十烷醇浓度的取值应设在8-15ppm。与沾蘸法相比,浸泡法所用的浓度较低,所需处理时间较长。
考查方向
本题主要考查了植物生长调节剂,旨在考查学生分析题图获取信息的能力,理解所学知识的要点,把握知识的内在联系并应用相关知识结合题干信息对某些生物学问题进行解释、推理、判断的能力。
解题思路
结合知识分析题干完成
易错点
空白对照
7.下列过程属于物理变化的有( )
①石油分馏得到汽油
②煤通过干馏获得焦炭
③用铝土矿冶炼铝
④用海带提取碘单质
⑤空气液化
⑥白酒变酸
⑦粉尘爆炸
⑧干冰气化
⑨同素异形体之间的互变
⑩氯化钠溶液通电后导电
⑪活性炭使红墨水褪色
⑫新制氯水使有色布条褪色
正确答案
解析
①石油分馏得到汽油,利用沸点不同,加以分离,没有新物质生成的变化,是物理变化;
②煤通过干馏获得焦炭,干馏是在高温条件下反应,有新物质生成的变化,是化学变化;
③用铝土矿冶炼铝,有新物质生成的变化,是化学变化;
④用海带提取碘单质, 有新物质生成的变化,是化学变化;
⑤空气液化,没有新物质生成的变化,是物理变化;
⑥白酒变酸,有新物质生成的变化,是化学变化;
⑦粉尘爆炸,有新物质生成的变化,是化学变化;
⑧干冰气化,没有新物质生成的变化,是物理变化;
⑨同素异形体之间的互变,有新物质生成的变化,是化学变化;
⑩氯化钠溶液通电后导电,没有新物质生成的变化,是物理变化;
⑪活性炭使红墨水褪色,没有新物质生成的变化,是物理变化;
⑫新制氯水使有色布条褪色,有新物质生成的变化,是化学变化;
属于物理变化的有①、⑤、⑧、⑩、⑾共计5个。
故选C。
考查方向
解题思路
化学变化是指有新物质生成的变化,物理变化是指没有新物质生成的变化,化学变化和物理变化的本质区别是否有新物质生成;据此分析判断。
易错点
本题考查物理变化与化学变化的判断,难度不大.要注意化学变化和物理变化的本质区别是否有新物质生成。
知识点
2.下列化工生产过程中,未涉及氧化还原反应的是
正确答案
解析
A.海带提碘是由KI变为I2,有元素化合价的变化,属于氧化还原反应,错误;B.氯碱工业是由NaCl的水溶液在通电时反应产生NaOH、Cl2、H2,有元素化合价的变化,属于氧化还原反应,错误;C.氨碱法制取碱的过程中没有元素化合价的变化,是非氧化还原反应,正确;D.海水提溴是由溴元素的化合物变为溴元素的单质,有元素化合价的变化,属于氧化还原反应,错误。故选项C正确。
考查方向
解题思路
氨碱法制取碱是把足量的氨气通入饱和的食盐水中,再通入足量的二氧化碳气体,利用碳酸氢钠的溶解度较小的特点使其沉淀析出。发生的反应方程式是:NH3+CO2+NaCl+H2O=NaHCO3↓+NH4Cl
易错点
物质的工业制备不清楚原理。
知识点
1.化学与社会、生活密切相关。对下列现象或事实的解释不正确的是( 
正确答案
C
解析
A.酸性高锰酸钾溶液具有强氧化性可氧化乙烯,故A正确。B. SiO2是酸性氧化物,只所以能溶于氢氟酸是硅具有亲氟性的原因,故B错。C.过氧化钠与二氧化碳反应变价元素只有过氧化钠中负一价的氧,并非二氧化碳被氧化,故C错误。D.Al(OH)3受热分解生成H2O并吸收大量的热量,使周围环境温度降低,且生成的氧化铝熔点较高,附着在可燃物表面,从而阻止可燃物燃烧,故D正确。
考查方向
解题思路
A.水果在生长过程中会产生植物激素,来促使植物的果实成熟。常常将浸泡有酸性高锰酸钾溶液的硅藻土放置在盛放水果的容器中,就可以用KMnO4的强氧化性将水果产生的乙烯氧化为CO2气体,由于乙烯浓度降低,所以保鲜时间可以更长一些,从而防止了水果的腐烂变质;B.氢氟酸与玻璃的主要成分SiO2发生反应:SiO2+4HF=SiF4↑+2H2O,故可用氢氟酸蚀刻玻璃,但在该反应中Si02不表现酸性;C.过氧化钠与二氧化碳反应变价元素只有过氧化钠中负一价的氧,过氧化钠既是氧化剂,又是还原剂,并非二氧化碳被氧化。D.Al(OH)3受热易分解,产生水并吸收热量,使周围环境温度降低,故可用作阻燃剂。
易错点
A.不了解高锰酸钾会吸收部分乙烯的原理是氧化作用。B.氢氟酸与Si02反应不是由于Si02酸性氧化物的性质;C.不清楚过氧化钠与二氧化碳反应中过氧化钠既是氧化剂,又是还原剂,并非二氧化碳被氧化。D.不仅Al(OH)3受热分解吸热,同时产生水并吸收热量,使周围环境温度降低。
知识点
重铬酸钠(Na2Cr2O7·2H2O)是重要的化工原料,在化学工业和制药工业中常用作氧化剂。可用一种铬铁矿(主要成分:FeO·Cr2O3,还含有少量的Al2O3)通过以下流程来制取重铬酸钠。
回答下列问题:
23.写出Cr元素基态原子的外围电子排布式____。
24.步骤I中反应的化学方程式为:4FeO·Cr2O3(s)+8Na2CO3(s)+7O2(g)=8Na2CrO4(s)+2Fe2O3(s)+8CO2(g),反应中被氧化的元素是 ,生成2 mol Fe2O3时转移电子的物质的量为 mol。
25.步骤II中加入NaOH溶液时发生的化学反应方程式为 。
26.+3、+6价铬都有很强的毒性,+6价铬的毒性更高,可诱发肺癌和鼻咽癌。工业上常用电解法来处理含Cr2O72-的废水,电解装置模拟示意图如右图(电极材料为铁和石墨)。通电后,Cr2O72-在b极附近转变为Cr3+,一段时间后Cr3+最终可在a极附近变成Cr(OH)3沉淀而被除去。a电极的电极材料是____,b电极附近生成Cr3+的反应的离子方程式是____。
27.将含Cr2O3为50%的铬铁矿30.4 kg,按上述流程制取产品Na2Cr2O7·2H2O,假设整个流程中铬元素的利用率为80%,则最终能制得Na2Cr2O7·2H2O kg。
正确答案
(1)3d54s1
解析
(1):Cr元素在第4周期,结合洪特规则,可知其有4个电子层,第一层2个电子,第二层排满8个电子,第三层最大容量18个电子,但由于亚层电子数量在半满态时性质比较稳定,故其亚层应该是3s23p63d5,第四层为一个电子,由于能级交错现象,其电子排布为1s22s22p63s23p64s13d5,由于习惯将相同电子层的写在一起,故为1s22s22p63s23p63d54s1,外层电子排布为3d54s1;
考查方向
解题思路
根据洪特规则,推断Cr元素的电子排布,由Al的两性写出其与碱的反应方程式,结合化学反应方程式及其中的化合价变化,判断电子的转移和其中反应物的物质的量之间的关系,根据点解的特性结合图示中的信息和电极材质的化学特性,判断相应电极的材质;由题目给出的反应物和生成物推断响应电极的电化学方程式;应用反应物和生成物中的关键元素物质的量守恒判断产物的质量,
易错点
相关规则和原理理解不清,以及点解的特点
正确答案
(2)Fe、Cr ;28
解析
(2):由化学方程式:4FeO·Cr2O3(s)+8Na2CO3(s)+7O2(g)=8Na2CrO4(s)+2Fe2O3(s)+8CO2(g)可知,其中化合价升高的有Fe元素和Cr元素,反应物和生成物相比,Fe2+→Fe3+,Cr3+→Cr6+,生成2mol的Fe2O3,参照反应式各个物质的系数,则同时生成8mol的Na2CrO4,故转移的电子物质的量为4mol+24mol=28mol;
考查方向
解题思路
根据洪特规则,推断Cr元素的电子排布,由Al的两性写出其与碱的反应方程式,结合化学反应方程式及其中的化合价变化,判断电子的转移和其中反应物的物质的量之间的关系,根据点解的特性结合图示中的信息和电极材质的化学特性,判断相应电极的材质;由题目给出的反应物和生成物推断响应电极的电化学方程式;应用反应物和生成物中的关键元素物质的量守恒判断产物的质量,
易错点
相关规则和原理理解不清,以及点解的特点
正确答案
(3)2NaOH+Al2O3=2NaAlO2+H2O
解析
(3):由于Al具有两性,故其氧化物与碱反应:Al2O3+NaOH=NaAlO2+H2O;
考查方向
解题思路
根据洪特规则,推断Cr元素的电子排布,由Al的两性写出其与碱的反应方程式,结合化学反应方程式及其中的化合价变化,判断电子的转移和其中反应物的物质的量之间的关系,根据点解的特性结合图示中的信息和电极材质的化学特性,判断相应电极的材质;由题目给出的反应物和生成物推断响应电极的电化学方程式;应用反应物和生成物中的关键元素物质的量守恒判断产物的质量,
易错点
相关规则和原理理解不清,以及点解的特点
正确答案
(4)石墨 ;Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
解析
(4):30.4kg 含50%Cr2O3的铬铁矿,其含Cr2O3为30.4kg×50% = 15.2kg,参与反应时其利用率为80%,则参与反应的Cr2O3为15.2kg×80% = 12.16kg,Cr2O3的相对原子质量为152,根据Cr元素物质的量守恒,1分子Cr2O3生成1分子的Na2Cr2O7·2H2O,而Na2Cr2O7·2H2O相对分子质量为298,所以相对分子质量之比:152 / 298 = 12.16 / M(Na2Cr2O7·2H2O) , 故M(Na2Cr2O7·2H2O)=23.84kg
考查方向
解题思路
根据洪特规则,推断Cr元素的电子排布,由Al的两性写出其与碱的反应方程式,结合化学反应方程式及其中的化合价变化,判断电子的转移和其中反应物的物质的量之间的关系,根据点解的特性结合图示中的信息和电极材质的化学特性,判断相应电极的材质;由题目给出的反应物和生成物推断响应电极的电化学方程式;应用反应物和生成物中的关键元素物质的量守恒判断产物的质量,
易错点
相关规则和原理理解不清,以及点解的特点
正确答案
(5)23.84
解析
考查方向
解题思路
根据洪特规则,推断Cr元素的电子排布,由Al的两性写出其与碱的反应方程式,结合化学反应方程式及其中的化合价变化,判断电子的转移和其中反应物的物质的量之间的关系,根据点解的特性结合图示中的信息和电极材质的化学特性,判断相应电极的材质;由题目给出的反应物和生成物推断响应电极的电化学方程式;应用反应物和生成物中的关键元素物质的量守恒判断产物的质量,
易错点
相关规则和原理理解不清,以及点解的特点
6. 中华文明源远流长,下面中国国宝级文物的表面不会因电化学腐蚀被氧化的是
正确答案
知识点
锗是重要的半导体材料,应用于航空航天测控、光纤通讯等领域。一种提纯二氧化锗粗品(主要含GeO2、As2O3)的工艺如下:
已知:①“碱浸”过程中的反应为:
GeO2+2NaOH=Na2GeO3+H2O
As2O3+2NaOH=2NaAsO2+H2O
②“蒸馏”过程中的反应为:Na2GeO3+6HCl=2NaCl+GeCl4+3H2O
③GeCl4的熔点为-49. 5 ℃,AsCl3与GeCl4的沸点分别为130.2℃、84℃。
27.锗的原子序数为32,锗在元素周期表中的位置为第 周期 族。
28.“氧化除砷”的过程是将NaAsO2氧化为Na3AsO4,其反应方程式为: 。
29.传统的提纯方法是将粗品直接加入盐酸中蒸馏,其缺点是 。
30.工业上与蒸馏操作相关的设备有
31.“水解”操作时发生的化学反应方程式为 ,“水解”操作时保持较低温度有利于提高产率,其最可能的原因是 (答一条即可)。
32.若1吨二氧化锗粗品(含杂质30%)经提纯得0.745吨的高纯二氧化锗产品,则杂质脱除率为 。
正确答案
第四周期;第IVA族
解析
36-32=4,Kr(36)是第四周期的稀有气体,所以是第四周期第ⅣA,差为4,所以是第ⅣA族。
考查方向
元素周期表知识点
解题思路
记住每个周期的稀有气体原子序数:第一周期He 2第二周期Ne10第三周期Ar 18
第四周期Kr 36第五周期Xe 54第六周期Rn 86。找到最邻近的求差36-32=4,Kr(36)是第四周期的稀有气体,所以是第四周期第ⅣA,差为4,所以是第ⅣA族。
易错点
无
教师点评
常识题,考察学生基本功。
正确答案
3NaAsO2+NaClO3+6 NaOH=3 Na3AsO4+NaCl+3H2O
解析
首先根据得失电子数相等写出 3NaAsO2+NaClO3 =3 Na3AsO4+NaCl,因为是题中流程图上标明加入了NaOH,根据钠元素和氢元素守恒写出答案:3NaAsO2+NaClO3+6 NaOH=3 Na3AsO4+NaCl+3H2O。
考查方向
这是一个典型的陌生情境下的化学方程式的书写题。
解题思路
氧化除砷的过程是将NaAsO2氧化为Na3AsO4,而NaClO3的还原产物可以根据氧化还原反应的规律来判断是NaCl,可以有得失电子数相等写出 3NaAsO2+NaClO3 =3 Na3AsO4+NaCl,因为是题中流程图上标明加入了NaOH,根据钠元素和氢元素守恒写出答案:3NaAsO2+NaClO3+6 NaOH=3 Na3AsO4+NaCl+3H2O。
易错点
在强碱性溶液中氯酸钠的还原产物是氯化钠,不是氯气。
教师点评
此题综合性较强,要能根据电子守恒和元素守恒来解答。
正确答案
馏出物中将会含有AsCl3,降低了产品纯度
解析
传统的提纯方法是将粗品直接加入盐酸中蒸馏,其缺点是馏出物中将会含有AsCl3,降低了产品纯度。
解题思路
粗品的成分是:GeO2、As2O3,As2O3与HCl反应生成AsCl3。
易错点
1、锗在元素周期表中的位置判定。2、水解”操作时发生的化学反应方程式书写。
正确答案
考查方向
正确答案
GeCl4+(n+2) H2O=GeO2·n H2O↓+4HCl;该水解反应为放热反应,温度较低时反应平衡常数较大,反应物平衡转化率更高;或温度高时GeCl4易挥发降低产率;
易错点
1、锗在元素周期表中的位置判定。2、水解”操作时发生的化学反应方程式书写。
正确答案
85%
易错点
1、锗在元素周期表中的位置判定。2、水解”操作时发生的化学反应方程式书写。
扫码查看完整答案与解析