- 尾气处理装置
- 共12题
4. 如图所示装置的气密性检查中,一定漏气的是( )
正确答案
解析
A、用手握住试管,试管内气体受热膨胀,在烧杯内有气泡产生,说明装置气密性良好,故A不选;
B、用弹簧夹夹住右边导管,向长颈漏斗中倒水,液面高度不变,说明装置气密性良好,故B不选;
C、用弹簧夹夹住右边导管,双手捂住烧瓶,烧瓶内气体受热膨胀,使集气瓶中气体压强增大,在玻璃管中形成一段水柱,说明装置气密性良好,故C不选;
D、用弹簧夹夹住右边导管,上下移动,若装置不漏气,两边液面应形成一定的高度差,而图示两端液面相平,说明装置漏气,故D选;
考查方向
本题主要考查气密性的检验。
解题思路
A项手握法:双手紧握试管,导管末端有少量气泡产生;松开手后导管内倒吸一段水柱,则装置气密性良好;B项液差法:漏斗内和锥形瓶内形成一个液面差,一段时间保持不变;C项手握法:广口瓶中导管内形成一段水柱且一段时间保持不变;D项气密性不好。
易错点
不能掌握气密性检验的方法和原理。
知识点
FeCl2是一种常用的还原剂。有关数据如下:
实验室可以用多种方法来制备无水FeCl2。回答下列问题:
按右图装置用H2还原无水FeCl3制取。
8.装置C的作用是 ;E中盛放的试剂是 ;D中反应的化学方程式为 。
9.温度控制不当,产品中含单质铁。检验产品中是否含铁的方案是 。
10.按右下图装置,在三颈烧瓶中放入162.5g无水氯化铁和225g氯苯,控制反应温度在128~139℃加热3h,反应接近100%。冷却,分离提纯得到粗产品。反应如下:
2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl
该制取反应中,作还原剂的是 。
11.反应温度接近或超过C6H5Cl的沸点,但实验过程中C6H5Cl并不会大量损失。原因是 。
12.冷却实验装置,将三颈瓶内物质经过过滤、洗涤,干燥后,将得到粗产品。
①洗涤所用的试剂可以是 ;
②回收滤液中C6H5Cl的方案是 。
13.仅通过烧杯中的现象变化就可以监控氯化铁的转化率。若要监控氯化铁转化率达到或超过90%,则烧杯中加入的试剂可以是 。
正确答案
干燥氢气 碱石灰 H2+2FeCl3=2FeCl2+2HCl
解析
分析实验过程,可知装置C的作用是干燥氢气,E中盛放的试剂应该是碱石灰,D中方程式 H2+2FeCl3=2FeCl2+2HCl。
考查方向
解题思路
分析该实验器材,写出装置C的作用是干燥氢气,同时E中盛放的试剂应该是碱石灰,写出D中反应的方程式。对下图装置进行分析,同时由方程式可得还原剂。
易错点
实验过程中加入指定试剂的作用
正确答案
取样,加入盐酸中,观察是否有气泡产生
解析
检验产品中是否含铁的方案是取样,加入盐酸中,观察是否有气泡产生
考查方向
解题思路
分析该实验器材,写出装置C的作用是干燥氢气,同时E中盛放的试剂应该是碱石灰,写出D中反应的方程式。对下图装置进行分析,同时由方程式可得还原剂。
易错点
实验过程中加入指定试剂的作用
正确答案
C6H5Cl
解析
分析方程式2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl可知还原剂为C6H5Cl 。
考查方向
解题思路
分析该实验器材,写出装置C的作用是干燥氢气,同时E中盛放的试剂应该是碱石灰,写出D中反应的方程式。对下图装置进行分析,同时由方程式可得还原剂。
易错点
实验过程中加入指定试剂的作用
正确答案
实验使用了冷凝回流装置
解析
反应温度接近或超过C6H5Cl的沸点,但实验过程中
C6H5Cl并不会大量损失。原因是因为该实验考虑周到,使用了冷凝回流装置
考查方向
解题思路
分析该实验器材,写出装置C的作用是干燥氢气,同时E中盛放的试剂应该是碱石灰,写出D中反应的方程式。对下图装置进行分析,同时由方程式可得还原剂。
易错点
实验过程中加入指定试剂的作用
正确答案
①苯 ②蒸馏滤液,并收集132℃馏分
解析
冷却实验装置,将三颈瓶内物质经过过滤、洗涤,干燥后,将得到粗产品。①洗涤所用的试剂可以是苯②回收滤液中C6H5Cl的方案是蒸馏滤液,并收集132℃馏分
考查方向
解题思路
分析该实验器材,写出装置C的作用是干燥氢气,同时E中盛放的试剂应该是碱石灰,写出D中反应的方程式。对下图装置进行分析,同时由方程式可得还原剂。
易错点
实验过程中加入指定试剂的作用
正确答案
滴有酚酞且含18g NaOH的溶液
解析
仅通过烧杯中的现象变化就可以监控氯化铁的转化率。若要监控氯化铁转化率达到或超过90%,则烧杯中加入的试剂可以是滴有酚酞且含18g NaOH的溶液 。
考查方向
解题思路
分析该实验器材,写出装置C的作用是干燥氢气,同时E中盛放的试剂应该是碱石灰,写出D中反应的方程式。对下图装置进行分析,同时由方程式可得还原剂。
易错点
实验过程中加入指定试剂的作用
8.下列操作或仪器的选用正确的是
正确答案
解析
A.在容量瓶内溶解浓硫酸,放出大量的热,会导致溶液体积偏大,配制溶液浓度偏大,甚至导致容量瓶受热不均发生破裂,故A错误;B.食盐水呈中性,铁在中性溶液中可发生吸氧腐蚀,故B正确;C.直接加热氯化铵固体,分解生成氨气和氯化氢,在温度稍低时又生成氯化铵,不能得到氨气,应用氯化铵和氢氧化钙固体加热反应制备氨气,故C错误;D.乙烯被酸性高锰酸钾溶液氧化,故D错误.
考查方向
解题思路
A.不能在容量瓶中稀释溶液;B.铁在中性溶液中可发生吸氧腐蚀;C.应用氯化铵和氢氧化钙固体加热反应制备氨气;D.乙烯被酸性高锰酸钾溶液氧化.
易错点
气体的制取、电化学腐蚀、溶液的配制、除杂
知识点
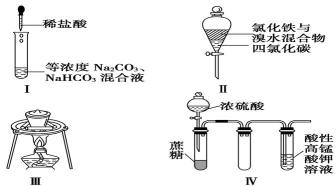
5.对于实验Ⅰ~Ⅳ的描述不正确的是()
①实验Ⅰ:逐滴滴加稀盐酸时,试管中开始没有立即产生大量气泡
②实验Ⅱ:充分振荡后静置,下层溶液为橙红色,上层无色
③实验Ⅲ:从饱和食盐水中提取氯化钠晶体
④实验Ⅳ:酸性KMnO4溶液中有气泡出现,且溶液颜色逐渐变浅乃至褪去
正确答案
解析
实验I :逐滴滴加稀盐酸时,首先发生反应:Na2CO3+HCl=NaCl+NaHCO3,当该反应完全反应后再发生NaHCO3+HCl=NaCl+H2O+ CO2↑。所以试管中不会马上产生大量气泡。
FeCl3溶于水而不能溶解于四氯化碳中,但Br2容易溶于四氯化碳而不容易溶解在水中。所以充分振荡后静置,会分层,下层溶液为橙红色,上层为黄色。
NaCl的溶解度受温度的影响变化较小,要从饱和食盐水中提取NaCl晶体应该选用蒸发皿来通过蒸发溶剂法得到。
浓硫酸有强氧化性,会把柘塘氧化为C、CO、CO2等,它本身被还原为SO2,SO2有还原性,能被酸性KMnO4溶液氧化二使其褪色。
考查方向
解题思路
实验Ⅰ,逐滴滴加盐酸时,首先发生反应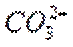
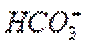
实验Ⅱ,充分振荡并静置后,上层为氯化铁溶液的颜色,应为浅黄色;
实验Ⅲ,加热蒸发饱和食盐水应用蒸发皿而不是坩埚;
实验Ⅳ,将浓硫酸滴入蔗糖中发生反应生成SO 2 和CO 2气体,SO 2 与酸性高锰酸钾溶液发生氧化还原反应,使之褪色。
易错点
分离操作的仪器选择;FeCl3与Br2反应后物质溶解性判定
知识点
31.某研究性学习小组选用以下装置进行实验设计和探究(图中a、b、c均为止水夹)
(1)在进行气体制备时,应先检验装置的气密性。将A装置末端导管密封后,在A装置的分液斗内装一定量的蒸馏水,然后_______________,则证明A装置的气密性良好。
(2)用锌粒和稀硫酸制各H2时应选用装置________作为发生装置(填所选装置的序号字母),实验时可先在稀硫酸溶液中加入少型硫酸铜晶体会使反应速率加快,原因是________________________。
(3)某同学利用上述装置设计实验证明Cl2氧化性强于Br2
①选用的装置连接顺序为:______→______→______(填所选装置的序号字母):
②从以下试剂中选用该实验所需的试剂为______(填试剂的序号字母):
a.浓硫酸
b.浓盐酸
c.二氧化锰
d.氯化钠
e.溴化钠溶液
③实验过程中能说明Cl2氧化性强于Br2的实验现象是_____________;
(4)另-同学将B、D、E装置连接后,茬套囊璧中加入铜片和浓硝酸,制取NO2,然后进行NO2气体与水反应的实验,并观察相关现象:
①B装置发生反应的离子方程式为__________________;
②反应一段时间后D装置中的具支试管乙中收集满NO2气体,若进行NO2气体与水反应的实验,应_______(填“对a、b、c三个止水夹进行的操作”),然后再适当加热乙。
③E装置中的NaOH溶液可吸收尾气NO2,反应生成NaNO3、NaNO2和H2O,反应中生成的NaNO3和NaNO2的物质的量之比为____________。
正确答案
(1)打开分液漏斗开关,水不能顺利流下,则气密性良好或打开分液漏斗开关水不能持续滴下或分液漏斗中液面长期保持不变,则气密性良好。
(2)B,Zn置换出铜与电解质溶液形成原电池
(3)
①A-C-E
②b 、c、 e
③ C中溶液的颜色变为(橙)黄色
(4)
①Cu + 4H+ + 2NO3- = Cu2+ + 2NO2↑ + 2H2O
②烧杯中的水进入试管中,试管中气体颜色变浅
③关闭止水夹a、b,打开止水夹c
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析