- 电子式
- 共50题
空气吹出法是最早工业化海水提溴的方法,适合从低浓度含溴溶液中提取溴。
(1)NaBr的电子式是 。
(2)反应①是将Br—转化为Br2,反应①的离子方程式是 。
(3)通入空气吹出Br2,并用Na2CO3吸收的目的是 。
(4)反应②的化学方程式是 。
(5)反应③中每生成3 mol Br2,转移电子的物质的量是 mol。
(6)为了除去工业Br2中微量的Cl2,可向工业Br2中 (填字母)。
a.通入HBr
b.加入NaBr溶液
c.加入Na2CO3溶液
d.加入Na2SO3溶液
正确答案
见解析。
解析
(1)
(2)Cl2+2Br—
(3)富集溴
(4)3Br2+3Na2CO3
(5)5
(6)b
知识点
海水是巨大的化学资源宝库。
Ⅰ.从海水中可以提取氯、溴、碘等卤族元素。
(1)Cl2的电子式是 。
(2)已知:X2 (g)+H2(g)
右图表示平衡常数K与温度t的关系。
①ΔH 表示X2与H2反应的焓变,ΔH 0。(填“>”、“<”或“=”)
② 曲线a表示的是 (填“Cl2”、“Br2”或“I2”)与H2反应时K与t的关系。
Ⅱ.海水淡化具有广泛的应用前景,淡化前需对海水进行预处理。
(1)通常用明矾[K2SO4·Al2(SO4)3·24H2O]作混凝剂,降低浊度。明矾水解的离子方程式是 。
(2)用下图所示NaClO的发生装置对海水进行消毒和灭藻处理。
① 装置中由NaCl转化为NaClO的化学方程式是 。
② 海水中含有Ca2+、Mg2+、HCO3-等杂质离子,处理过程中装置的阴极易产生水垢,其主要成分是Mg(OH)2和CaCO3。生成CaCO3的离子方程式是 。
③ 若每隔5-10 min倒换一次电极电性,可有效地解决阴极的结垢问题。
试用电极反应式并结合必要的文字进行解释 。
正确答案
见解析。
解析
Ⅰ.(1) 
(2)① <(2分);
② Cl2(2分)。
Ⅱ.(1)Al3++3H2O
(2)① 
2NaOH+Cl2=NaClO+NaCl+H2O ;
② Ca2++HCO3-+OH-=CaCO3↓+H2O ;
③ 阴极结垢后倒换电极电性,阴极变为阳极,其电极反应为:2Cl--2e-=Cl2↑,产生的氯气与水发生反应:Cl2+H2O=HCl+HClO,使该电极附近溶液呈酸性,从而将Mg(OH)2和CaCO3溶解而达到除垢的目的。
知识点
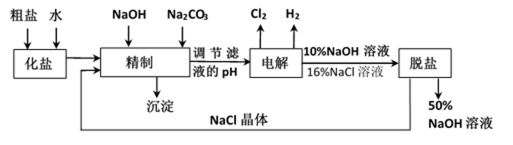
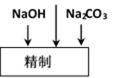
氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
依据上图完成下列问题:
(1)在电解过程中,阴极上生成气体的电子式为 。
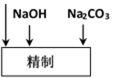
(2)精制过程中除去阳离子中的Ca2+、Mg2+等杂质,除去Mg2+的离子方程式为 。
(3)精制过程要除去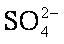
a. Ba(OH)2
b.Ba(NO3)2
c.BaCl2
(4)在实际生产中也可以用BaCO3除去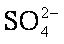
(5) 脱盐工作中,利用NaOH和NaCl在溶解度上的差异,通过蒸发、冷却、 、 (填操作名称)而制得50%的NaOH溶液。
正确答案
见解析。
解析
(1)H:H
(2)Mg2++2OH-=Mg(OH)2↓
(3)ac
(4)由于BaSO4比BaCO3的溶解度小,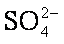

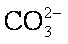
平衡正向移动,生成更难溶的BaSO4沉淀。
(5)结晶、过滤
知识点
水是最宝贵的资源之一。下列表述正确的是
正确答案
解析
略
知识点
27.氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
依据上图完成下列问题:
(1)在电解过程中,阴极上生成气体的电子式为 。
(2)精制过程中除去阳离子中的Ca2+、Mg2+等杂质,除去Mg2+的离子方程式为 。
(3)精制过程要除去SO42-,可选择下列溶液中的 (填字母序号)
a. Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(4)在实际生产中也可以用BaCO3除去SO42-(已知溶解度BaSO4<BaCO3),试用平衡移动原理加以解释: 。
(5) 脱盐工作中,利用NaOH和NaCl在溶解度上的差异,通过蒸发、冷却、 、 (填操作名称)而制得50%的NaOH溶液。
(6)写出电解饱和食盐水的离子方程式:
正确答案
(1)H:H
(2)Mg2++2OH-=Mg(OH)2↓
(3)ac
(4)由于BaSO4比BaCO3的溶解度小,促使BaCO3(s)Ba2+(aq)+ (aq)
平衡正向移动,生成更难溶的BaSO4沉淀。
(5)结晶、过滤
(6)
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析