- 热化学方程式
- 共127题
某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM25(直径小于等于2.5
请回答下列问题:
(1)将PM25样本用蒸馏水处理制成待测试样。
若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
根据表中数据判断PM25的酸碱性为 ,试样的pH= 。
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+


写出焦炭与水蒸气反应的热化学方程式: 。
②洗涤含SO2的烟气。以下物质可作洗涤剂的是 。
a。Ca(CH)2 b。Na2CO3 c。CaCl2 d。NaHSO3
(3)汽车尾气中NOx和CO的生成及转化
①已知汽缸中生成NO的反应为:


若1mol空气含0.8molN2和0.2molO2,1300oC时在密闭容器内反应达到平衡,测得NO为8×10-4mol。计算该温度下的平衡常数K= 。
汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是 。
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:
2CO(g)=2C(s)+O2(g)
已知该反应的△H
③目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为
。
正确答案
见解析
解析
解析:。
知识点
某小组根据工业生产原理设计如下转化关系,以获取烧碱和金属钛(Ti)。
(1) 燃料电池中通入氧气的电极是 (填“正”或“负”)极,电极反应式是 ;用该电池电解饱和食盐水,若消耗32 g甲醇,理论上Ⅰ中可生成NaOH ________mol。
(2)如图所示,理论上加入Ⅱ中的TiO2和焦炭的物质的量之比是 ;由TiCl4得到金属Ti的化学方程式是 。
(3)根据Ⅲ中合成甲醇的反应,该小组保持温度不变,在两个相同的恒容密闭容器中进行实验,有关实验数据如下:
① P1 4MPa(填“>”、“<”或“=”);
② 实验Ⅰ条件下合成甲醇的热化学方程式是 。
正确答案
见解析。
解析
(1)正 
(2)1﹕2
(3)①<
②
知识点
工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
某小组研究在相同温度下该反应过程中的能量变化。他们分别在体积均为V L的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应。相关数据如下:

“小于”或“等于”)生成物分子化学键形成时所释放的总能量。
(2)容器①中反应达平衡时,CO的转化率为 %。
(3)计算容器②中反应的平衡常数K= 。
(4)下列叙述正确的是 (填字母序号)。
a.平衡时,两容器中H2的体积分数相等
b.容器②中反应达平衡状态时,Q > 65.6 kJ
c.反应开始时,两容器中反应的化学反应速率相等
d.容器①中,反应的化学反应速率为:
(5)已知:2H2 (g) + O2 (g) == 2H2O (g) ΔH=-484 kJ/mol,写出CO完全燃烧生成CO2
的热化学方程式: 。
(6)容器①中反应进行到t min时,测得混合气体中CO2的物质的量为0.6 mol。若用
200 mL 5 mol/L的NaOH溶液将其完全吸收,反应的离子方程式为(用一个离子方
程式表示) 。
正确答案
见解析。
解析
(1)小于
(2)80
(3)1
(4)a
(5)2CO(g) + O2(g) === 2CO2(g) △H = -566 kJ/mol
(6)3CO2 + 5OH- === 2CO32- + HCO3- + 2H2O
知识点
工业上以粗食盐(含有少量Ca2+、Mg2+杂质)、氨、石灰石等为原料,可以制备Na2CO3。其过程如下图所示。
请回答:
(1)在处理粗盐水的过程中,可加入石灰乳和纯碱作为沉淀剂,则所得滤渣的成分
除过量的沉淀剂外还有 。
(2)将CaO投入含有大量的NH4Cl的母液中,能生成可循环使用的NH3,该反应的
化学方程式是 。
(3)向饱和食盐水中首先通入的气体是 ,过程Ⅲ中生成NaHCO3晶体的反
应的化学方程式是 。
(4)碳酸钠晶体失水的能量变化示意图如下:
Na2CO3·H2O (s) 脱水反应的热化学方程式是 。
(5)产品纯碱中常含有NaCl。取a g混合物与足量稀盐酸充分反应,加热、蒸干、
灼烧,得b g固体。则该产品中Na2CO3的质量分数是 。
(6)熔融Na2CO3可作甲烷——空气燃料电池的电解质,该电池负极的反应式
是 。
正确答案
见解析。
解析
(1)CaCO3、Mg(OH)2
(2)2NH4Cl+CaO=CaCl2+2NH3↑+H2O
(3)NH3 NH3+H2O+CO2+NaCl =NaHCO3↓+NH4Cl
(4)Na2CO3·H2O(s)= Na2CO3(s) +H2O(g) ΔH = + 58.73 kJ·mol-1
(5)106(b-a)/11a
(6)CH4-8e-+4CO32-=5CO2+2H2O
知识点
11.为了保护环境,充分利用资源,某研究小组通过如下简化流程,将工业制硫酸的硫铁矿烧渣(铁主要以Fe2O3存在)转变成重要的工业原料FeSO4(反应条件略)
活化硫铁矿还原Fe2+的主要反应为:FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4,不考虑其他反应,请回答下列问题:
(1)第1步H2SO4与Fe2O3反应的离子方程式是( )。
(2)检验第II步中Fe3+是否完全还原,应选择( ) (填字母编号)。
A.KMnO4溶液
B.K2[Fe(CN)4]溶液
C.KSCN溶液
(3)第III步加FeCO3调溶液pH到5.8左右,然后再第VI步通入空气使溶液pH降到5.2,此时Fe2+不沉淀,滤液中铝、硅杂质除尽。通入空气引起溶液pH降低的原因是( )。
(4)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。
(5)已知25℃,101kPa时:4Fe(s)+3O2(g)=2Fe2O3(s) 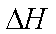
C(s)+O2(g)=CO2(g) 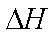
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s) 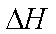
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是( )。
(6)加入烧渣中的铁全部视为Fe2O3,其含量为50%。将a kg质量分数为b%的硫酸加入到c kg烧渣中浸取,铁的浸取率为96%,其他杂质浸出消耗掉饿硫酸以及调pH后溶液呈微酸性所残留的硫酸忽略不计。按上述流程,第III步应加入FeCO3 ( )kg。
正确答案
(1)Fe2O3+6H+=2Fe3++3H2O
(2)C
(3)Fe2+被氧化为Fe3+,Fe3+水解产生H+。
(4)4FeCO3(s)+O2(g) =2Fe2O3(s)+ 4CO2(g) 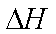
(5)FeS2+4Li++4e-= Fe+2 Li2S或FeS2+4e-= Fe +2S2-
(6)0.0118ab-0.646c或-kg。
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析












