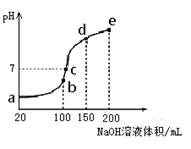- 热化学方程式
- 共127题
火力发电厂释放出大量氮氧化物(NOx)、SO2和CO2等气体会造成环境问题。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:
CH4(g) + 4NO2(g) =4NO(g) + CO2(g) + 2H2O(g) △H1=-574 kJ·mol-1
CH4(g) + 4NO(g) =2N2(g) + CO2(g) + 2H2O(g) △H2=-1160 kJ·mol-1
甲烷直接将NO2还原为N2的热化学方程式为_________。
(2)脱碳。将CO2转化为甲醇:CO2(g)+3H2(g)
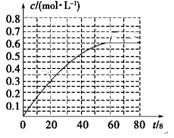
①在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2进行上述反应。测得CO2和CH3OH(g)浓度随时间变化如图1所示。回答:0~10 min内,氢气的平均反应速率为_________mol/(L·min);第10 min后,保持温度不变,向该密闭容器中再充入1 mol CO2(g)和1 mol H2O(g),则平衡_________(填“正向”、“逆向”或“不”)移动。
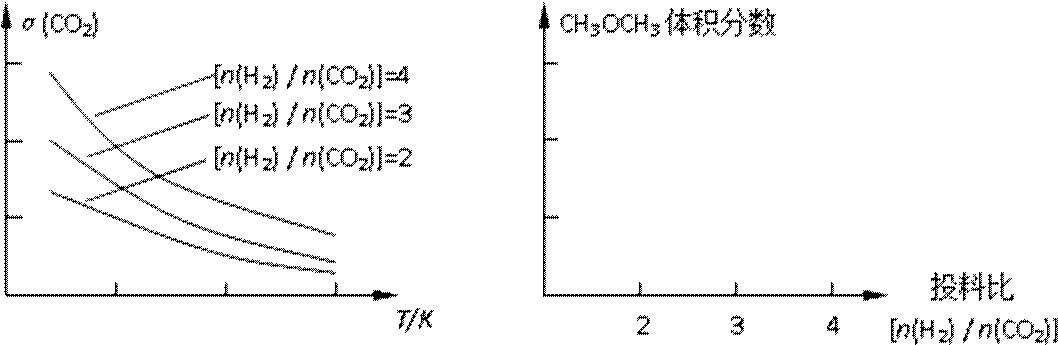
②取五份等体积的CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图2所示,则上述CO2转化为甲醇的反应的△H3_________0(填“>”、“<”或“=”)。
(3)脱硫。利用Na2SO3溶液可脱除烟气中的SO2。Na2SO3可由NaOH溶液吸收SO2制得。NaOH溶液吸收SO2的过程中,pH随n(SO32-)︰n(HSO3﹣)变化关系如下表:
① 由上表判断,NaHSO3溶液显_________性,用化学平衡原理解释:_________。
② 当溶液呈中性时,离子浓度关系正确的是(选填字母):_________。
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+) > c(HSO3-) > c(SO32-) > c(H+) = c(OH-)
c.c(Na+) + c(H+) = c(SO32-) + c(HSO3-) + c(OH-)
正确答案
(1)CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867 kJ•mol-1
(2)①0.225;正向;②O2 + 4e-+ 4H+=2H2O;0.005;③<
(3)①酸;溶液中存在:HSO3-

解析
略。
知识点
大气中的部分碘源于O3对海水中I-的氧化。将O3持续通入NaI溶液中进行模拟研究。
(1)O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+ O3(g)= IO-(aq)+O2(g)△H1
②IO-(aq)+H+(aq) 
③HOI(aq) + I-(aq) + H+(aq) 
总反应的化学方程式为________,其反应△H=________。
(2)在溶液中存在化学平衡:I2(aq) + I-(aq) 
(3) 为探究Fe2+ 对O3氧化I-反应的影响(反应体如图13),某研究小组测定两组实验中I3-浓度和体系pH,结果见图14和下表。
①第1组实验中,导致反应后pH升高的原因是________。
②图13中的A为__ ___,由Fe3+生成A的过程能显著提高Ⅰ-的转化率,原因是________。
③第2组实验进行18s后,I3-浓度下降。导致下降的直接原因有(双选)________。
A. c(H+)减小
B. c(I-)减小
C. I2(g)不断生成
D. c(Fe3+)增加
(4)据图14,计算3-18s内第2组实验中生成I3-的平均反应速率(写出计算过程,结果保留两位有效数字)。
正确答案
(1) O3+2Ⅰ—+2H+=Ⅰ2+ O2+ H2O,△H=△H1+△H2+△H3。
(2)
(3)反应过程中消耗氢离子,溶液酸性减弱,pH增大,水电离出氢离子参与反应破坏水的电离平衡,氢氧根浓度增大,溶液呈碱性,pH增大;Fe3+,该过程是非氧化还原;BD
(4)(计算过程略)5.5×10—4 mol/L·s
解析
略。
知识点
如何降低大气中CO2的含量及有效地开发利用CO2,已引起了全世界的普遍重视。“低碳经济”正成为科学家研究的主要课题。
(1)已知: ① CO(g)+H2O(g)
② C(s)+2H2(g)
③ 2CO(g)
写出CO2与H2反应生成CH4和H2O的热化学方程式 。
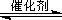
已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2) / n(CO2)]的变化曲线如下左图:
①在其他条件不变时,请在下图中画出平衡时CH3OCH3的体积分数随投料比[n(H2)/n(CO2)]变化的曲线图。
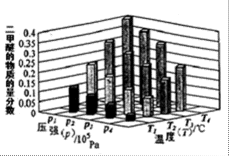
②某温度下,将2.0molCO2(g)和6.0mol(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如图所示,关于温度和压强的关系判断正确的是 ;
③在恒容密闭容器里按体积比为1:3充入二氧化碳和氢 气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是 ;
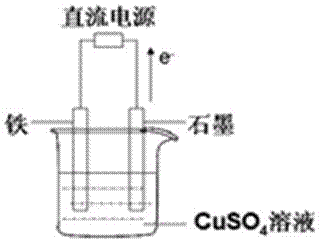
(3)最近科学家再次提出“绿色化学”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇。甲醇可制作燃料电池,写出以稀硫酸为电解质甲醇燃料电池负极反应式____ 。以此燃料电池作为外接电源按右图所示电解硫酸铜溶液,如果起始时盛有1000mL pH=5的硫酸铜溶液(25℃,CuSO4足量),一段时间后溶液的pH变为1,此时可观察到的现象是 ;若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入 (填物质名称),其质量约为 g。
正确答案
(1)CO2(g)+4H2(g) 
(2) ①画图
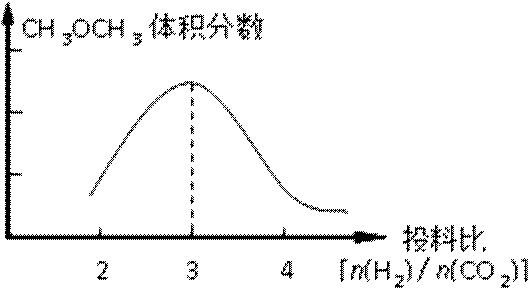
②BD (2分)
③ B (2分)
(3)CH3OH+H2O-6e-=CO2+6H+ (2分)
石墨电极表面有气泡产生,铁电极上附着一层红色物质,溶液颜色变浅(2分),氧化铜(或碳酸铜)(2分),4g(或6.2g)(2分)
解析
略
知识点
碳、氮、硫是中学化学重要的非金属元素,在工农业生产中有广泛的应用。
(1)用于发射“天宫一号”的长征二号F火箭的燃料是液态偏二甲肼(CH3-NH-NH-CH3),氧化剂是液态四氧化二氮。二者在反应过程中放出大量能量,同时生成无毒、无污染的气体。已知室温下,1 g燃料完全燃烧释放出的能量为42.5kJ,请写出该反应的热化学方程式________。
(2)298K时,在2L的密闭容器中,发生可逆反应:2NO2(g)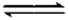
①298k时,该反应的平衡常数为________L ·mol-1。
②下列事实能判断该反应处于平衡状态的是________。
a.混合气体的密度保持不变
b.混合气体的颜色不再变化
c. V(N2O4)正=2V(NO2)逆
③若反应在398K进行,某时刻测得n(NO2)=0.6 mol n(N2O4)=1.2mol,则此时
V(正)________V(逆)(填“>”“<”或“=”)。
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。现向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。
试分析图中a、b、c、d、e五个点,
①水的电离程度最大的是________;
②其溶液中c(OH-)的数值最接近NH3·H2O的电离常数K数值的是________。
③在c点,溶液中各离子浓度由大到小的排列顺序是________。
正确答案
(1)C2H8N2(l)+2N2O4(l)=2CO2(g)+3N2(g)+4H2O(l) ΔH=-2550 kJ·mol-1
(2)①6.67;②b;③<
(3)①b;②d;③c(Na+)>c(SO)>c(NH)>c(OH-)=c(H+)
解析
略。
知识点
用氮化硅陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅,其反应如下:
(1) SiCl4的平均反应速率为___
(2)平衡后,若改变温度,混合气体的平均相对分子质量与温度的
关系如图所示,下列说法正确的是
A.该反应在任何温度下可自发进行
B,若混合气体的总质量不变,表明上述反应己达到平衡状态
C、其他条件不变,增大Si3N4的物质的量,平衡向左移动
D.按3:2:6的物质的量比增加反应物,SiC14(g)的转化率降低
(3)下表为不同温度下该反应的平衡常数,其他条件相同时,在___(填"T1”、“T2”.,
“T3”)温度下反应达到平衡所需时间最长:
假设温度为T1时向该反应容器中同时加入。(SiC14) =0.3 mol/L,c(H2) =0.3 mol/L,,c(N2) =
x mol/L, c (HCD =0.3 mol/L和足量Si3N4 (s),若要使平衡建立的过程中HCl浓度减小,x的取值
范围为___
(4)该反应的原子利用率为____
(5)工业上制备SiCl4的反应过程如下:
写出二氧化硅、焦炭与Cl 2在高温下反应生成气态SiC14和一氧化碳的热化学方程式_____
正确答案
(1)
(2)AB(2分)
(3)
(4))24.22%(2分)
(5)
解析
略
知识点
铁、铜及其化合物在工农业生产中应用广泛。
(1)在潮湿空气中,钢铁发生电化学腐蚀转化为Fe(OH)2的反应方程式为_________。在含有等浓度硫酸溶液的下列装置中,铁腐蚀的速率由快到慢的顺序是_________(用序号填写)。
(2)已知:3Fe(s)+2O2(g)=Fe3O4(s) 
2Al(s)+3/2O2(g)=A12O3(s) 
则焊接钢轨时铝与Fe3O4发生反应生成铁和Al2O3的热化学方程式为_________。
(3)Na2FeO4具有强氧化性,其电解制法如图所示,请写出阳极的电极反应式_________。Na2FeO4是一种既能杀菌、消毒,又能絮凝净水的水处理剂,其原理是_________。
(4)工业上常用FeCl3溶液腐蚀印刷线路板,发生反应的离子方程式是_________。
若腐蚀铜板后的溶液中,Cu2+、Fe3+和Fe2+浓度均为0.1 mol·L-1 ,结合下图分析,当混合溶液中通入氨气调节溶液的pH=5.6时,溶液中存在的金属阳离子为_________。从图中数据计算Fe(OH)2的溶度积Ksp[Fe(OH)2]=_________。
已知:横坐标为溶液的pH,纵坐标为金属离子的物质的量浓度的对数(当溶液中金属离子浓度
正确答案
(1)2Fe + O2 + 2H2O = 2Fe(OH)2;⑤③②①④
(2)8Al(s)+3Fe3O4(s)=4Al2O3(s)+9Fe(s) △H= −3348.8 kJ·mol-1
(3)Fe + 8OH- -6e-= FeO42- + 4H2O;Na2FeO4具有强氧化性,能起到杀菌、消毒作用;高价的铁被还原成的Fe3+水解生成Fe(OH)3胶体,能吸附水中杂质。
(4)2Fe3+ + Cu = 2Fe2+ +Cu2+;Cu2+、Fe2+;1.0
解析
略。
知识点
金属钛被称为“21世纪金属”。
(1)工业上用钛矿石(含FeTiO3,含FeO、Al2O3、SiO2等杂质)经过以下流程制得TiO2:
其中,步骤Ⅱ发生的反应为:2H2SO4 + FeTiO3 = TiOSO4 + FeSO4 + 2H2O
①步骤Ⅰ中发生反应的化学方程式: ________________、________________。
②将步骤Ⅱ所得FeSO4晶体溶于水,在酸性条件下加入H2O2溶液,可制得具有净水作用的铁盐,该反应的离子方程式为 。
③在步骤Ⅲ中需要控制条件以形成TiO2·nH2O胶体,该分散质颗粒直径大小在____________范围。
(2)可利用TiO2通过下述两种方法制备金属钛:
方法一:将TiO2作阴极,石墨作阳极,熔融CaO为电解液,用碳块作电解槽池,电解TiO2制得钛,其阴极发生的反应:_____________。
方法二:通过以下反应制备金属钛
① TiO2(s) + 2Cl2(g) 
② TiCl4 + 2Mg 
在实际生产中,需在反应①过程中加入碳才能顺利制得TiCl4,其原因是: 。
(3)若已知:C(s) + O2(g) = CO2(g) △H= -394kJ/mol ,则由固体TiO2、固体C与Cl2气反应制取气态TiCl4的热化学方程式为____________
正确答案
见解析。
解析
(1)①__ Al2O3_+ 2NaOH = 2NaAlO2 + H2O SiO2 + 2NaOH = Na2SiO3 + H2O
② 2Fe2+ +H2O2+2H+ = 2Fe3+ + 2H2O ③ 1~100nm
(2) TiO2 + 4e- = Ti + 2O2-
利用高温使碳与O2反应减小O2的浓度,并利用反应放热,使生成更多TiCl4
(3)TiO2(s) + 2Cl2(g) + C(s) = TiCl4(g) + CO2(g);△H= -243kJ/mol
知识点
某学习小组为研究低价态氮元素物质的还原性,以NH3为例设计了如下图实验(夹持设备略去)
I.检验气密性后关闭弹簧夹I打开弹簧夹II,点燃酒精灯,铜丝红热后打开分液漏斗的活塞,A中气体进入B中时不断通入空气,反应一段时间后熄灭酒精灯。
II.当D中有明显现象时关闭弹簧夹II;打开弹簧夹I
(1)能证明有氨气产生的现象是 ;氨分子电子式为 。
(2)C中铜丝在熄灭酒灯后仍保持红热说明其中反应为 热反应(填“吸热”或“放热”NH3在C中反应的化学方程式为 。
(3)D中产生红棕色气体和白烟,产生白烟的化学方程式为:
(4)F中也产生大量白烟,写出该反应中反应物的物质的量之比n(NH3):n(Cl2)
(5)用化学方程式及相应理论说明A中能产生大量NH3气体的原因 ,比较某时刻A中分液漏斗溶液平衡常数K1和三颈瓶中溶液的平衡常数K2大小关系,K1 K2(填“<”“=”“>”)。
(6)装置中A稍有不足,应该怎样改进 。














正确答案
见解析。
解析
(1)A中湿润的红色石蕊试纸变蓝;
(2)放热 ,
(3)HNO3 + NH3 = NH4NO3
(4)8:3
(5)
(6)装置中A装置分液漏斗与三颈瓶之间增加一气压平衡管。
(7)Cu(s)+H2O2 (l)+2H+(aq)=Cu2+(aq)+2H2O(l) △H=-319.68KJ.mol-1
知识点
化合物甲由不同周期的短周期元素X、Y组成,是良好的耐热冲击材料。
X原子的最外层电子数比次外层电子数少5, Y元素是空气中含量最高的元素。
(1)X的原子结构示意图是 ,甲的化学式是
(2)X的硫酸盐溶液与过量
(3) 1mol X单质与Fe2O3反应,放出414.21 KJ热量,该反应的热化学反应方程式是 。
(4)利用以X为阳极,在H2SO4 溶液中电解的方法,可在X表面形成X的氧化物,此方法可用于工业制备氧化膜,写出阳极电极反应式 。
(5)一定条件下,甲和水缓慢作用生成含Y的化合物乙,乙分子含有10个电子。乙在微生物作用下可与O2发生反应,当有1 mol 乙参加反应时,电子转移6 mol,该反应的化学方程式是 。
正确答案
见解析。
解析
(1)
(2)Al3++4OH-===AlO2-+2H2O
(3)2Al(s) + Fe2O3(s) === Al2O3(s) +2Fe(s) △H = -828.42 kJ/mol
(4)2Al+3H2O-6e-= Al2O3+ 6H+
(5)
知识点
I.已知:C(s)+H2O(g)
一定温度下,在1.0 L密闭容器中放入1 mol C(s)、1 mol H2O(g)进行反应,反应时间(t)与容器内气体总压强(p)的数据见下表:
回答下列问题:
(1)下列哪些选项可以说明该可逆反应已达平衡状态 。
A.混合气体的密度不再发生改变 B.消耗1 mol H2O(g)的同时生成1 mol H2
C.ΔH不变 D.v正(CO) = v逆(H2)
(2)由总压强P和起始压强P0表示反应体系的总物质的量n总,n总=____ mol;由表中数据计算反应达平衡时,反应物H2O(g)的转化率α =_____(精确到小数点后第二位)。
Ⅱ.硫单质及其化合物在工农业生产中有着重要的应用。
(1)已知25℃时:xSO2 (g)+2xCO(g)=2xCO2 (g)+Sx (s) ΔH=ax kJ/mol
2xCOS(g)+xSO2 (g)=2xCO2 (g)+3Sx (s) ΔH=bx kJ/mol。
则反应COS(g)生成CO(g)、Sx (s)的热化学方程式是 。
(2)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中H2S、HS−、S2−的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如右图所示(忽略滴加过程H2S气体的逸出)。试分析:
①B曲线代表 分数变化(用微粒符号表示);滴加过程中,溶液中一定成立:
c(Na+)= 。
②M点,溶液中主要涉及的离子方程式 。
正确答案
I.(1)AD (2)P/P0 ; 79.82%(或0.80)
II.(1)①xCOS(g) = xCO(g)+ Sx(s) ; ΔH=0.5(bx-ax)kJ/mol
(2)①HS-; c(Na+)=3[c(H2S)+c(HS-)+c(S2-)](由物料守恒得出)
或c(Na+)= c(Cl-)+c(OH-)+c(HS-)+2c(S2-)-c(H+)(由电荷守恒得出)
②M:2S2-+3H+=HS-+H2S
解析
略
知识点
扫码查看完整答案与解析