- 热化学方程式
- 共127题
以锌锰废电池中的碳包(含碳粉、Fe、Cu、Ag和MnO2等物质 )为原料回收MnO2的工艺流程如下:
I. 将碳包中物质烘干,用足量稀HNO3溶解金属单质,过滤,得滤渣a;
II. 将滤渣a在空气中灼烧除去碳粉,得到粗MnO2;
III. 向粗MnO2中加入酸性H2O2溶液,MnO2溶解生成Mn2+,有气体生成;
IV. 向III所得溶液(pH约为6)中缓慢滴加0.50 mol•L-1 Na2CO3溶液,过滤,得滤渣b,其主要成分为MnCO3;
V. 滤渣b经洗涤、干燥、灼烧,制得较纯的MnO2。
(1)Ι中Ag与足量稀HNO3反应生成NO的化学方程式为 。
(2)已知II的灼烧过程中同时发生反应:
MnO2(s) + C(s) === MnO(s) + CO (g) △H = +24.4 kJ • mol - 1
MnO2(s) + CO(g) === MnO(s) + CO2(g) △H = -148.1 kJ • mol - 1
写出MnO2和C反应生成MnO和CO2的热化学方程式: 。
(3)H2O2分子中含有的化学键类型为 、 。
(4)III中MnO2溶解的化学方程式为 ,溶解一定量的MnO2,H2O2的实际消耗量比理论值高,用化学方程式解释原因: 。
(5)IV中,若改为“向0.50 mol•L-1 Na2CO3溶液中缓慢滴加III所得溶液”,滤渣b中会混有较多Mn(OH)2沉淀,解释其原因: 。
(6)V中MnCO3在空气中灼烧的化学方程式为 。
正确答案
见解析。
解析
(1)3Ag+4HNO3=3AgNO3+NO↑+2H2O
(2)2MnO2(s)+C(s)=2MnO(s)+CO2(g) △H=-123.7kJ·mol-1
(3)极性共价键 非极性共价键
(4)MnO2+H2O2+2H+=Mn2++O2↑+2H2O 2 H2O2 
(5)Na2CO3溶液pH>7显碱性,III所得溶液pH约为6 显弱酸性,后者滴加到前者中,溶液中c(OH-)较大,Mn2+与OH-生成Mn (OH)2沉淀(或答CO32-的水解平衡正向移动生成Mn (OH)2沉淀)
(6)2MnCO3+O2 
知识点
I. 下图是在101 kPa,298K条件下1mol NO2(g)和1mol CO(g)反应生成1mol CO2(g)和1mol NO(g)过程中的能量变化示意图。
已知:①N2(g) +O2(g) ===2NO(g) ΔH = +179.5 kJ/mol
②2NO(g) +O2(g) ===2NO2(g) ΔH = -112.3 kJ/mol
请写出NO与CO反应生成无污染气体的热化学方程式: 。
Ⅱ. 一种光化学电池的结构如上图,当光照在表面涂有氯化银的银片上时,AgCl(s)Ag(s)+Cl(AgCl),[Cl(AgCl)]表示生成的氯原子吸附在氯化银表面,接着Cl(AgCl)+e-→ Cl-(aq),Pt电极周围溶液变蓝。若将光源移除,电池会立即回复至初始状态。
①光照时,电流由 极流向 极(填X或Y)
②光照时,电池总反应为 。
Ⅲ. 在一定的温度下,把2体积N2和6体积H2分别通入一个带活塞的体积可变的容器中,活塞
N2(g)+3H2(g) 
反应达到平衡后,测得混合气体为7体积。
请据此回答下列问题:
(1)保持上述反应温度不变,设a、b、c分别表示加入的N2、H2 和NH3的体积,如果反应达到平衡后混合气体中各物质的量仍与上述平衡时完全相同。
①a=1,c=2,则b= 。在此情况下,反应起始时将向 反应方向(填“正”或“逆”)进行。
②若需规定起始时反应向逆方向进行,则c的取值范围是 。
(2)在上述恒压装置中,若需控制平衡后混合气体为6.5体积,则可采取的措施是 ,原因是 。
正确答案
I.2NO(g) +2CO(g) ===N2(g) +2 CO2(g) ; ΔH = -759.8 kJ/mol
II.①X ; Y
② AgCl(s)+Cu+(aq)Ag(s)+Cu2+(aq)+Cl-
III.(1)① 3 ; 逆 ② 1<c≤4
(2)降低温度;降低温度平衡向正反应方向移动,气体总分子数减少
解析
略
知识点
综合利用CO2对环境保护及能源开发意义重大。
(1)Li2O、Na2O、MgO均能吸收CO2。如果寻找吸收CO2的其他物质,下列建议合理的是______。
a . 可在碱性氧化物中寻找
b. 可在ⅠA、ⅡA族元素形成的氧化物中寻找
c. 可在具有强氧化性的物质中寻找
(2)Li2O吸收CO2后,产物用于合成Li4SiO4,Li4SiO4用于吸收、释放CO2。原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是______。
(3)利用反应A可将释放的CO2转化为具有工业利用价值的产品。

已知:
① 反应Ⅱ是_____反应(填“吸热”或“放热”),其原因是 。
② 反应A的热化学方程式是_______。
(4)高温电解技术能高效实现(3)中反应A,工作原理示意图如下:
① 电极b发生 (填“氧化”或“还原”)反应。
② CO2在电极a放电的反应式是______。
(5)CO与H2在高温下合成C5H12(汽油的一种成分)减少碳排放。已知燃烧1 mol C5H12(g)生成H2O(g)放出约3 540 kJ的热量。根据化学平衡原理,说明提高合成C5H12的产率可采取的措施是______。
正确答案
见解析。
解析
(1)ab
(2)
(3)① 吸热 反应物总能量低于生成物总能量(或ΔH>0)
② CO2(g) + H2O(g) ==CO(g) + H2(g) +O2(g) ΔH = +524.8 kJ·mol-1
(4)① 氧化
② CO2 + 2e- == CO+O2-
(5)增大压强或及时将生成的C5H12分离出去或降低温度
知识点
硫化物在自然界中的部分循环关系如下。
(1)H2S在空气中可以燃烧。
已知: 2H2S(g) + O2(g) 
S(s) + O2(g) 
H2S(g)与O2(g)反应产生SO2(g)和H2O(g)的热化学方程式是 。
(2)SO2是大气污染物,海水具有良好的吸收SO2的能力,其过程如下。
① SO2溶于海水生成H2SO3,H2SO3最终会电离出SO32—,其电离方程式是 。
② SO32—可以被海水中的溶解氧氧化为SO42—。海水的pH会 (填“升高” 、“不变”或“降低”)。
③ 为调整海水的pH,可加入新鲜的海水,使其中的HCO3—参与反应,其反应的离子方程式是 。
④ 在上述反应的同时需要大量鼓入空气,其原因是 。
(3)自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透,遇到难溶的ZnS,慢慢转变为铜蓝(CuS),用化学用语表示由ZnS转变为CuS的过程: 。
(4)SO2和O2在H2SO4溶液中可以构成原电池,其负极反应式是 。
正确答案
见解析。
解析
(1)2H2S(g)+3O2(g) 
(2)① H2SO3

② 降低
③ HCO3 —+ H+ 
④提高脱硫海水的溶解氧,将SO32-氧化成为SO42-,有利于平衡H2SO3

(3)
(4)负极:SO2 - 2e—+ 2H2O 
知识点
下列说法中正确的是
正确答案
解析
略
知识点
高纯晶体硅是信息技术的关键材料。
(1)硅元素位于周期表的______周期______族,在周期表的以下区域中,可以找到类似硅的半导体材料的是________(填字母序号)。
a. 过渡元素区域
b. 金属和非金属元素的分界线附近
c. 含有氟、氯、硫、磷等元素的区域
(2)工业上用石英砂和焦炭可制得粗硅。
已知:
请将以下反应的热化学方程式补充完整:
SiO2(s) + 2C(s) === Si(s) + 2CO(g) △H = ________
(3)粗硅经系列反应可生成硅烷(SiH4),硅烷分解生成高纯硅。已知硅烷的分解温度远低于甲烷,用原子结构解释其原因:_________,Si元素的非金属性弱于C元素,硅烷的热稳定性弱于甲烷。
(4)将粗硅转化成三氯氢硅(SiHCl3),进一步反应也可制得高纯硅。
①SiHCl3中含有的SiCl4、AsCl3等杂质对晶体硅的质量有影响。根据下表数据,可用________ 方法提纯SiHCl3。
②用SiHCl3制备高纯硅的反应为
a. 该反应的平衡常数随温度升高而增大
b. 横坐标表示的投料比应该是
c. 实际生产中为提高SiHCl3的利用率,应适当升高温度
正确答案
见解析。
解析
(1)三 ⅣA b
(2)+638.4 kJ·mol-1
(3)C和Si最外层电子数相同(或“是同主族元素”),C原子半径小于Si(或“C原子电子层数少于Si”)
(4)①蒸馏(或分馏)
②a、c
知识点
如图是某条件时N2与H2反应过程中能量变化的曲线图。下列叙述正确的是
正确答案
解析
略
知识点
研究减少有毒气体的排放对改善环境消除雾霾有十分重要的意义。
(1)①科学家设想将温室气体CO2转化为有机物来有效实现碳循环
以上反应中不仅体现了绿色化学思想,且原子利用率最高的是________。
②工业上常用NH3和(NH4)2CO3通过下列反应捕获CO2,以降低温室气体CO2的排放
则△Ha与△Hb、△Hc之间的关系是:△Ha=________。
(2)利用I2O5消除CO污染的反应为:5CO(g)+I2O5(s)= 5CO2(g)+I2(s) △H。 不同温度下,向装有足量I2O5固体的2 L恒容密闭容器中通入4molCO,测得CO2的体积分数

①该反应属于________反应(填“放热”或“吸热”)。
②从反应开始至a点时的反应速率为v(CO)=________,b点时化学平衡常数Kb=________。
③下列说法不正确的是________(填字母序号)。
A. 容器内气体密度不变,表明反应达到平衡状态
B. 两种温度下,c点时体系中混合气体的压强相等
C. 增大d点的体系压强,CO的转化率不变
D. b点和d点的化学平衡常数:Kb<Kd
(3)工业上,用Na2SO3溶液作为吸收液吸收烟气中的SO2,吸收液吸收SO2的过程中,室温时溶液中的c(H+)随n(SO32-):n(HSO3-)变化关系如下表:
①上表判断Na2SO3溶液显 性,HSO3-的电离常数为________。
②当吸收液呈中性时,溶液中离子浓度大小关系是________。
正确答案
(1)①b;②2△Hc-△Hb
(2)①放热;②1.6 mol·L-1·min-1;1024 或者45;③bd
(3)①碱;6.3×10-8 mol·L-1;②c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
解析
略。
知识点
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(1)在T℃和mPa时,将0.6molH2和0.4molN2置于一固定容积为2 L的密闭容器中发生反应:
3H2+N2
①0~8分钟NH3的平均生成速率为________mol·L-1·min-1。
②反应3H2+N2
(2)仍在T℃和mPa时,将0.6molH2和0.4molN2置于一容积可变的密闭容器中。(反应过程中保持温度压强不变)
①下列各项能说明该反应已达到平衡状态的是________(填序号)。
a.容器内N2、H2、NH3的浓度之比为1∶3∶2
b.3v(N2)(正) = v(H2)(逆)
c.3v(H2)(正) = 2v(NH3)(逆)
d.混合气体的密度保持不变
e.容器中气体的平均相对分子质量不随时间而变化
②该条件下达到平衡时NH3的体积分数与题(1)条件下NH3的体积分数相比________(填“变大”“变小”或“不变”)
③达到平衡后,改变某一条件使反应速率发生了如图所示的变化,改变的条件可能是________。
a.升高温度,同时加压
b.降低温度,同时减压
c.保持温度、压强不变,增大反应物浓度
d.保持温度、压强不变,减小生成物浓度
(3)NH3是合成硝酸的基础原料,请写出NH3在催化条件下被O2氧化的化学反应方程式________。
硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气。氨气等能将氮氧化物还原为氮气和水,其反应机理为:
2NH3(g)+5NO2(g)=7NO(g) +3H2O(g); △H=-akJ·mol-1
4NH3(g)+6NO(g)=5N2(g)+ 6H2O(g); △H=-bkJ·mol-1
则NH3直接将NO2还原为N2的热化学方程式为:________。
若标准状况下NO与NO2 混合气体40.32L (1.80 mol)被足量氨水完全吸收,产生标准状况下氮气42.56L (1.90 mol)。该混合气体中NO与NO2的体积之比为________。
正确答案
(1)①0.0125;②14.8
(2)①bde;②变小;③c
(3)4NH3+5O2Pt△4NO+6H2O;6NO(g)+4NH3(g)=5N2(g)+6H2O(g)△H=-(6a+7b/5)kJ·mol-1;1﹕2
解析
略。
知识点
工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素。霾是由
空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾。
(1)SO2在烟尘的催化下形成硫酸的反应方程式是__________。
(2)NOx和SO2在空气中存在下列平衡:
2NO(g) + O2(g) 
2SO2(g) + O2 (g) 
SO2通常在二氧化氮的存在下,进一步被氧化,生成SO3。
① 写出NO2和SO2反应的热化学方程式为________。
② 随温度升高,该反应化学平衡常数变化趋势是________。
(3)提高2SO2 + O2
① T温度时,在1L的密闭容器中加入2.0 mol SO2和1.0 mol O2,5 min后反应达到
平衡,二氧化硫的转化率为50%,该反应的平衡常数是_______。
② 在①中条件下,反应达到平衡后,改变下列条件,能使SO2的转化率提高的是
_________(填字母)。
a.温度和容器体积不变,充入1.0 mol He
b.温度和容器体积不变,充入1.0 mol O2
c.在其他条件不变时,减少容器的体积
d.在其他条件不变时,改用高效催化剂
e. 在其他条件不变时,升高体系温度
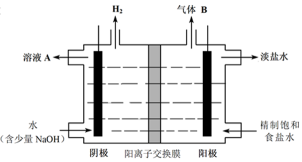
(4)工业上利用氯碱工业产品治理含二氧化硫的废气。下图是氯碱工业中电解饱和食盐水的原理示意图。
① 电解饱和食盐水的化学方程式是 。
② 用溶液A吸收含二氧化硫的废气,其反应的离子方程式是 。
③ 用含气体B的阳极区溶液吸收含二氧化硫的废气,其反应的离子方程式是
。
正确答案
见解析。
解析
(1) SO2 + H2O = H2SO3 2 H2SO3 + O2 2H2SO4
(2)① NO2(g) + SO2(g) = SO3(g) + NO(g) △H = -41.8 kJ·mol-1
② 减小
(3) ① 2
② b c
(4)① 2NaCl + 2H2O
② SO2 + OH- =HSO3- (或SO2 + 2OH- =SO32- + H2O)
③ SO2 + Cl2 + H2O =4H+ + SO42- + 2Cl-
知识点
扫码查看完整答案与解析