- 热化学方程式
- 共127题
27.节能减排是当今社会的热门话题,研发混合动力汽车对于中国汽车业的未来具有重要的战略意义。混合动力汽车持续工作时间长,动力性好的优点,无污染、低噪声的好处,汽车的热效率可提高10%以上,废气排放可改善30%以上,某种混合动力汽车的动力系统由“1.6L汽油机十自动变速器十20kW十200V镍氢电池”组成。
①混合动力汽车所用的燃料之一是乙醇,lg乙醇完全燃烧生成CO2气体和液态H2O放出30.0kJ热量,写出乙醇燃烧的燃烧热的热化学方程式( )。

③常温下,同浓度的Na2CO3溶液和NaHCO3溶液的pH都大于7,两者中哪种的pH更大,其原因是 ( )。0.1mol·L-1 Na2CO3中阴高子浓度大小关系是( ),向0.1mol·L-1 Na2CO3溶液中滴入少量氢氧化钡溶液,则发生反应的离子方程式为:( )。
(2)二氧化锰、锌是制备干电池的重要原料,工业上用软锰矿(含MnO2)和闪锌矿(含ZnS)
联合生产二氧化锰、锌的工艺如下:
①操作Ⅰ需要的玻璃仪器是( ) 。
②软锰矿(含MnO2)和闪锌矿与硫酸反应的化学方程式为( ),上述电解过程中,当阴极生成6.5g B时阳极生成的MnO2的质量为( ) 。
③利用铝热反应原理,可以从软锰矿中提取锰,发生的化学方程式为( ) 。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28.2013年12月2日,我国在西昌卫星发射中心用“长征三号甲”运载火箭将“嫦娥三号”探月卫星成功送入太空,进一步向广寒宫探索。“长征三号甲”是三级液体助推火箭,一、二级为常规燃料,常规燃料通常指以肼(N2H4)为燃料,以二氧化氮做氧化剂。
Ⅰ.常规燃料通常指以肼(N2H4)为燃料,以二氧化氮做氧化剂。但有人认为若用氟气代替二氧化氮作氧化剂,反应释放的能量更大(两者反应生成氮气和氟化氢气体)。
已知:N2H4(g)+O2(g)=N2(g)+2H2O(g) △H = -543kJ·mol-1


H2(g)+ 
请写出肼和氟气反应的热化学方程式:_____________________________。
Ⅱ.氧化剂二氧化氮可由NO和 O2生成,已知在2 L密闭容器内,800 ℃时反应:

(1) 已知:K800℃>K1000℃,则该反应的ΔH ______0(填“大于”或“小于”),用O2表示从0~2 s内该反应的平均速率为__________。
(2)能说明该反应已达到平衡状态的是________。
a.容器内颜色保持不变
b. 2v逆(NO)=v正(O2)
c.容器内压强保持不变
d.容器内密度保持不变
(3)为使该反应的速率增大,提高NO的转化率,且平衡向正反应方向移动应采取的措施有_______。
(4)在上述条件下,计算通入2 mol NO和1 mol O2的平衡常数K=______________。
(5)在上述条件下,若开始通入的是0.2 mol NO2气体,达到化学平衡时,则NO2的转化率为 ______。
正确答案
Ⅰ.N2H4(g)+2F2(g)=N2(g)+4HF(g) △H=-1135kJ·mol-1
Ⅱ.(1)小于 0.015 mol·L-1·s-1
(2) a 、c
(3)通入氧气、增大压强
(4)720 (5)25%
解析
解析已在路上飞奔,马上就到!
知识点
26.(I)某氮肥厂氨氮废水中的氮元素多以NH4+和NH3·H2O的形式存在。在微生物作用下,NH4+经过两步反应被氧化成NO3-,两步反应的能量变化示意图如下:
(1)1molNH4+(aq)全部氧化成NO3-(aq)的热化学方程式是 ________。
(2)在一定条件下,向废水中加入CH3OH,将HNO3还原成N2,若该反应消耗32gCH3OH转移6mol电子,则参加反应的还原剂和氧化剂的物质的量之比是________。
(Ⅱ)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:
2NO+2CO
某温度下用气体传感器测得不同的时间的NO和CO浓度如下表:
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)在上述条件下反应能够自发进行,则反应的△H _____ 0(填写“>”、“<”、“=”)
(2)前2s内的平均反应速率v(N2)= ______;
(3)在该温度下,反应的平衡常数K= _______(只写出计算结果);
(4)某同学设计了三组实验,分别验证温度、催化剂比表面积对化学反应速率的影响规律,部分实验条件如下表:
该同学画出了表中三个实验条件下,混合气体中NO浓度随时间变化的趋势曲线图,请在图上标明各条曲线的实验编号;
(5)有人认为:催化剂比表面积增大,会提高NO和CO的反应效率,从而使污染物NO和CO的转化率提高。请用化学基本理论对此观点进行评价:________。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27.人工固氮是指将氮元素由游离态转化为化合态的过程。据报道,常温、常压、光照条件下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,生成的主要产物为NH3,相应的热化学方程式为:N2(g)+3H2O(l)

Ⅰ.请在下图所示的坐标中画出上述反应在有催化剂和无催化剂两种情况下反应体系中的能量变化示意图,并进行标注。
Ⅱ.目前工业合成氨的原理是:N2(g)+3H2(g)
回答下列问题:
(1)表示氢气燃烧热的热化学方程式为 _________________ 。
(2)在恒温恒容密闭容器中进行的合成氨反应,下列能表示达到平衡状态的是_________(填序号)。
a.混合气体的压强不再发生变化
b.混合气体的密度不再发生变化
c.反应容器中N2、NH3的物质的量的比值不再发生变化
d.单位时间内断开a个N-N键的同时形成6 a个N-H键
e.三种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比
(3)在恒温恒容的密闭容器中,合成氨反应的各物质浓度变化曲线如下图所示。请回答下列问题:
①表示N2的浓度变化的曲线是______________ (选填曲线代号“A”、“B”或“C”)。
②前25 min 内,用H2的浓度变化表示的化学反应平均速率是_____________ 。
③在25 min 末反应刚好达到平衡,则该温度下反应的平衡常数K = ___________ (计算结果可用分数表示)。若升高温度,该反应的平衡常数值将_______(填“增大”、“减小”或“不变”)。
(4)在一定温度下,将1 mol N2和3 mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8 mol 。
①达平衡时,H2的转化率α1 = ____________。
②在相同条件下,若起始时只将NH3置于该容器中,达到平衡状态时NH3的转化率为α2,当α1 + α2 =1时,则起始时n (NH3)= ________mol。
正确答案
Ⅰ.
或
Ⅱ.(1)1/2O2(g)+ H2(g)==H2O(l) △H=-286.0 kJ/mol
(2)ac
(3)①C ②0.12mol•L-1•min-1 ③4/27(或0.148、0.15) 减小
(4)①60% ②2
解析
解析已在路上飞奔,马上就到!
知识点
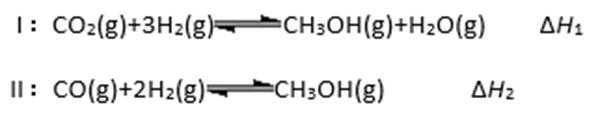
27.能源短缺是人类面临的重大问题,甲醇是一种可再生能源,具有广泛的开发和应
用前景。工业上一般采用下列两种方法合成甲醇:
(1)上述反应符合“原子经济”原则的是( )(填“Ⅰ”或“Ⅱ”),
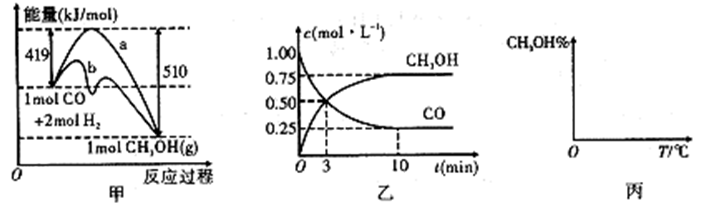
(2)图中甲图表示用反应Ⅱ生产燃料甲醇反应过程中能量的变化情况;乙图表示一定温度下,在体积2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间的变化情况。
请回答下列问题。
①下列说法正确的是( )(填字母序号)。
a.在甲图中,曲线b表示使用了催化剂
b.起始充入的CO为2mol,从反应开始到达到平衡,v(H2)=0.075mol.L-1.min-1
c.增大CO的浓度,CO的转化率增大
d.容器中压强恒定时,说明反应已达平衡状态
e.保持温度和密闭容器的容积不变,再充入1mol CO和2mol H2,再次达到平衡时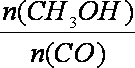
②该温度下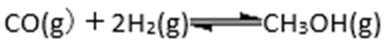
③请在丙图所示坐标图中画出平衡时甲醇的百分含量(纵坐标)随温度(横坐标)的变化曲线,要求画出压强不同的两条曲线(在曲线上标出P1、P2且P1<P2)。
(3)甲醇的一个重要作用是可以制燃料电池,常用KOH作电解质溶液,负极的电极反应式为( )
(4)已知CO(g)和CH3OH(l )的燃烧热△H分别为-283.0 kJ·mol1和-726.5kJ·mol1。甲醇不完全燃烧生成CO和液态水的热化学方程式为( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析