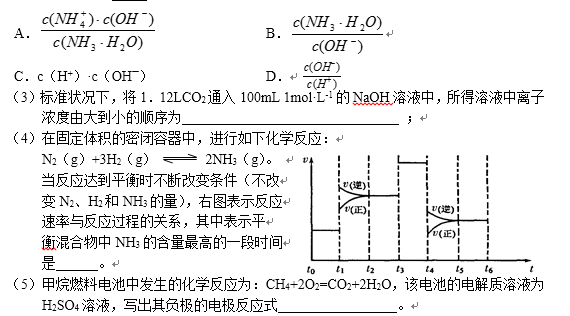
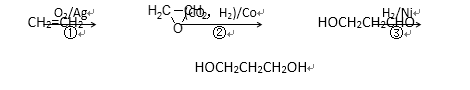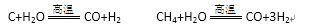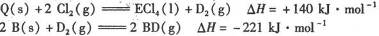- 热化学方程式
- 共127题
13.二甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能;二甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455 kJ/mol;工业上用合成气(CO、H2)直接或间接制取二甲醚。下列叙述正确的是 ( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27.(15分)甲醇被称为21世纪的新型燃料,工业上用CH4和H2O为原料通过下列反应①和②,来制备甲醇。
①CH4(g)+H2O(g)
②CO(g)+2H2(g)
将0.20 mol CH4和0.30 mol H2O(g)通入容积为10 L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度的关系如图。
(1)若反应①在温度为100°C 、压强为P时达平衡的时间为( )
10min,则从反应开始到平衡的v(H2)=( );平衡常数值K=( );温度升高到200°C 时K值( )(填“增大”、“减小”或“不变”);若反应①要自发进行应选择( )(填高温或低温)。
(2)如图所示,保持温度不变,将2molH2和1molCO加入甲容器中,将2mol甲醇蒸气加入乙容器中,隔板K不能移动(两容器内均发生反应②)。此时控制活塞P,使乙的容器为甲的2倍。
① 若移动活塞P,使乙的容器和甲相等,达到新平衡时,CH3OH(g)的体积分数甲( )乙(填“大于”、“小于”或“等于”)。
② 若保持乙中压强不变,向甲、乙两容器通入等质量的氦气,达到新平衡时,CH3OH(g)的体积分数甲( ) 乙(填“大于”、“小于”或“等于”)。
(3)已知在常温常压下:
①CH3OH(l)+O2(g)= CO(g)+2H2O(g) △H= -359.8 kJ·mol-1
② 2CO(g)+O2(g)=2CO2(g) △H= -556.0 kJ·mol-1
③ H2O(g)=H2O(l) △H= -44.0 kJ·mol-1
写出体现甲醇燃烧热的热化学方程式( ) 。
正确答案
(1)0.003mol·L-1 ·min-1 、 1.35×10-3、增大、高温(每空2分)
(2)①小于(2分)②大于(2分)
(3)CH3OH(l)+3O2(g)= CO2(g)+2H2O(l) △H= -725.8 kJ·mol-1(3分)
解析
解析已在路上飞奔,马上就到!
知识点
14.(10分)碳、氮元素及其化合物与人类的生产生活密切相关。试回答下列有关问题:
(1)图是1molNO2和1molCO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式( ) 。
(2)NH3极易溶于水,其水溶液俗称氨水。用水稀释0.1mol·L-1的氨水,溶液中随着水量的增加而减小的是 ( )(填序号)。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28. A、B、C为三种短周期元素,核电荷数依次增大,且A、B、C三种元素的原子核外电子层数之和为5。已知A是原子结构最简单的元素,B元素原子最外层上的电子数是其电子层数的2倍,A和C之间可形成A2C和A2C2两种化合物。请回答下列问题。
(1)C元素在元素周期表中的位置是 ( );
(2)化合物A2C2的电子式为( )。
(3)常温下,三种由A与B形成的气态化合物X、Y、Z,它们分子中A与B的原子个数皆满足N(A)=2N(B)+2,且B原子个数小于或等于4。当化合物质量满足2m(Y)=m(X)+m(Z),完全燃烧生成B的最高价氧化物时消耗O2的物质的量同时满足2n(Y)=n(X)+n(Z)。则Y的化学式可能为( ),若X、Y、Z中B原子个数比为1∶2∶3,则Z的化学式为( )。
(4)有机化合物E、M分子式不同,它们可能含A、B、C元素中的两种或三种。如果将E、M无论以何种比例混合,只要其物质的量之和不变,与氧气完全反应生成的B的最高价氧化物和消耗的氧气的物质的量也不变。则E、M组成必须满足的条件是( )。
(5)已知在101kPa时,15.0 g Y(分子中B原子数小于3)在氧气中完全燃烧生成BC2和A2C,放出热量324 kJ(25℃时),Y的燃烧热化学方程式是:
_____________________________________________________________________。
(6)Y ─ 空气燃料电池是一种碱性燃料电池。(Y分子中B原子数小于3)电解质溶液是20%~30%的KOH溶液。则燃料电池放电时:
负极的电极反应式______________________________________。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27.由碳的氧化物直接合成乙醇燃料已进入大规模生产。下图是由二氧化碳合成乙醇的技术流程:
吸收池中盛有饱和碳酸钾溶液,把含有二氧化碳的空气吹入吸收池中,吸收池中反应液进入分解池后,向分解池中通入高温水蒸汽,把二氧化碳从溶液中提取出来,在合成塔中和氢气经化学反应使之变为可再生燃料乙醇。回答下列问题:
(1)写出吸收池中反应的离子方程式__________。
(2)从分解池中循环使用的物质是_____________。
(3)工业上还采取以CO和H2为原料合成乙醇,其化学反应方程式为:
2CO(g)+4H2(g)
写出该反应的化学平衡常数表达式 K= _______________________ 。
(4)在相同条件下,由CO制取CH3CH2OH的平衡常数远远大于由CO2制取CH3CH2OH
的平衡常数。则由CO制取CH3CH2OH相比由CO2制备CH3CH2OH的优点是___________________
(写出一点即可);
(5)已知:一定条件下,2.0g乙醇完全燃烧生成液态水放出59.43kJ的热量,在该条件下:
①写出表示乙醇燃烧热的热化学方程式___________。②若以乙醇作燃料,KOH作电解质,构成燃料电池,请写出负极的电极方程式:____________。
(6)在一定压强下,测得由CO2制取CH3CH2OH的实验数据如下表:
根据表中数据分析:温度升高,该反应的平衡常数K值 _________(选填“增大”、“减小”或“不变”);
正确答案
(1)CO2 + CO32- + H2O =2HCO3- (2)K2CO3 (3)
(4)是使原料有较大的转化率 (其它合理答案均可给分) (5)①C2H5OH(l) + 3O2(g) =2CO2(g) + 3H2O(l); △H=-1366.89kJ/mol ②C2H5OH-12e-+16OH-=2CO32-+11H2O (6)减小
解析
解析已在路上飞奔,马上就到!
知识点
28.利用焦炭或天然气制取廉价的CO和H2,再用于氨合成和有机合成是目前工业生产的重要途径。回答下列问题:
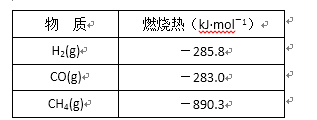
(1)甲烷在高温下与水蒸气反应的化学方程式为:CH4+H2O=CO+3H2。部分物质的燃烧热数据如下表:
已知1 mol H2O(g)转变为1 mol H2O(l)时放出44.0 kJ热量。写出CH4和水蒸气在高温下反
应的热化学方程式 ( )。
(2)500℃、50MPa时,在容积为V L的容器中加入1 mol N2、3 mol H2,,此时N2的转化率为a。则平衡时NH3的浓度为 ( )。
(3)1,3―丙二醇是重要的化工原料,用乙烯合成1,3―丙二醇的路线如下:
某化工厂已购得乙烯11.2 t,考虑到原料的充分利用,反应②、③所需的CO和H2可由以下两个反应获得:
假设在生产过程中,反应①、②、③中各有机物的转化率均为100%。且反应②中CO和H2、反应③中H2的转化率都为80%,计算至少需要焦炭( )吨、甲烷( )吨,才能满足生产需要。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
29.(14分)合成氨和制备硝酸是两种重要的化工生产,四川某化工厂将合成氨与制备硝酸进行连续生产。其工艺流程见右图:
(1)在某温度下体积为200L的氨合成塔中,以分为单位的时间点上测得各物质的浓度(mol·L-1)如下表:
根据表中数据得知0 min~2 min内N2的平均反应速率是( ),若用CH4与过量水蒸气反应来制氢气,再与氮气合成氨,则理论上CH4与NH3的物质的量之比是( )。
(2)今对合成氨反应进行如下研究:
在容积均为10L的a、b、c三个相同密闭容器中分别充入1mol N2和3 mol H2,三个容器的反应温度分别为T1、T2、T3,在其他条件相同情况下,实验测得反应均进行到5min时,NH3的体积分数如右图所示。则下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
26.有A、D、E、X、Y、Z、W七种元素,其中A、D、E、X、Y、Z是原子序数依次增大的短周期主族元素。X原子最外层电子数是其内层电子总数的3倍;X、Y同族;A与X、Y既不同族也不同周期;D元素的某种同位素原子在考古方面有重要应用;W是一种常见的金属,其元素的含量位于地壳中元素含量的第四位。
⑴ Y形成的简单阴离子结构示意图为( ▲ ) 。
⑵ 甲由A、E两种元素组成,分子中含有18个电子,只存在共价单键,常温下甲是一种无色液体。甲在碱性溶液中能够将CuO还原为Cu2O,已知当1mol甲完全参加反应时转移了4 mol电子,则该反应的化学方程式可表示为: ( ▲ )。
⑶ 处理含DX、YX2烟道气污染的一种方法,是在催化剂作用下使两者反应,产物之一为单质Y。已知反应生成 1 gY固体单质时放出8.4kJ热量,
此反应的热化学方程式为( ▲ )。
⑷ 由钠和X、Z三种元素组成的一种阴、阳离子个数之比为1 :1的化合物乙,其溶液显碱性,则该化合物所含的化学键类型有( ▲ ) 。将化合物乙加入到WZ2的溶液中,当转移2mol电子时,溶液中发生的离子反应方程式为:( ▲ )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
10.在25℃、101 kPa下,白磷(化学式为P4)、红磷(化学式为P)燃烧的热化学方程式分别为:P4(s) + 5O2(g) = P4O10(s);ΔH=-3093.2 kJ·mol-1
4P(s) + 5O2(g) = P4O10(s);ΔH =-2954.0 kJ·mol-1 由此判断下列说法正确的是()
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
26. 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期。A是原子 半径最小的元素;B的基态原子中电子占fe三种能量不同的原子轨道,且每种轨道中的电子总数相 同;D原子的核外成对电子数是未成对电子数的3倍;E有“生物金属”之称,E4+和氩原子的核外 电子排布相同。A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1 : 1的化合物N是常见的有机溶剂。
请回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
(1)A2D2分子的电子式为______,E的基态原子的外围电子排布式为______。
(2)B、C、D三种元素的第一电离能由小到大的顺序为______。
(3)单质B与C的最高价氧化物的水化物的浓溶液微热反应,其化学方程式 为______
(4)下列叙述正确的是______(填序号)。
a. M是极性分子,N是非极性分子 b. M和BD2分子中的中心原子均采用sp2杂化
c. N分子中含有6个σ键和1个π键 d. BD2晶体的熔点、沸点都比二氧化硅晶体的低
(5) 已知:①E的一种氧化物Q,其晶胞结构如右图所示
②
写出物质Q和焦炭、氯气反应生成液态ECI4和BD气体的热化学方程式:
_____________________________________
(6)在0.5 L的密闭容器中,一定量的C2和A2进行如下化学反应:C2(g) +3 A2(g) == 2CA3(g) ΔH<0,其化学平衡常数K与温度t的关系如下表。请回答下列问题。
2 试比较K1,K2的大小,K1________K2(填写“ >”、“=”或“<”)。
②在4000C时,当测得CA3和C2、A2的物质的量分别为3mol和1 mol、2 mol时,则该反应的 V(C2)正_________(C2)逆(填写“>”、“=”或“<”)。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析