- 离子方程式的书写
- 共269题
24.海洋中有丰富的食品、矿产、能源、药物和水产资源等,海洋经济越来越受到人们的重视。请填写下列空白。
(1)从海水提取食盐,工业上可以制氯气、氢气。写出该反应的离子方程式( ) 。
(2)资料查明:海水中Mg2+浓度约为Mg 1.29 g /kg,海水的平均密度:1.024g/cm3,Ksp[Mg(OH)2] = 1.1×10-11 。要富集海水中的镁离子,加入生石灰,要使溶液氢氧根离子浓度的至少达到( ) 。(请保留3位有效数字)
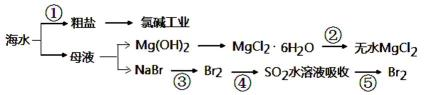
(3)利用海水得到粗盐、无水氯化镁和溴等的生产流程示意图:
i. 过程②中结晶出的MgCl2·6H2O要制得无水MgCl2需在HCl氛围中加热脱水的原因_____
_____________________________________________________________________________。
ii. 从循环经济等综合考虑,在过程③的离子方程式为_______________________________。
从反应后的溶液中分离出溴单质的操作是:向溶液中加入CCl4、 、分离出溴单质。
iii. ④和⑤反应的意义是____________________________________________________。
iv. 除去粗盐中的SO42-、Ca2+、Mg2+等杂质,需要用到的试剂为________(填序号)。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
13、25℃时,有下列四种溶液:①0.1mol/L 的CH3COOH溶液 ②pH=13的NaOH溶液
③ 0.05mol/L的 H2SO4 ④0.1mol/L 的Na2CO3溶液 则下列有关说法中正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
10.下列离子方程式正确的是 ( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
26.铜是与人类关系非常密切的有色金属,已知常温下,在溶液中Cu2+稳定,Cu+易在酸性条件下发生;
(1)工业上以黄铜矿为原料,采用火法熔炼工艺生产铜。该工艺的中间过程会发生反应:
(2)在CuCl2溶液中逐滴加入过量KI溶液可能发生:


①若a反应是主要的,需要查询的数据是( ) 。
②为顺利观察到白色沉淀可以加入的最佳试剂 ( ) 。
A.SO2 B.四氯化碳 C.NaOH D.乙醇
(3)一定条件下,在CuSO4中加入NH5反应生成氢化亚铜(CuH)。
①已知NH5的所有原子都达到稀有气体的稳定结构,请写NH5电子式:( ) 。
②写出CuH在过量稀盐酸中有气体生成的离子方程式 ( )。
③将CuH溶解在适量的稀硝酸中, 完成下列化学方程式
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
24.硫酸铁铵 [a(NH4)2SO4·bFe2(SO4)3·cH2O] 常作为高铁的标准,可用于测定卤素的指示剂。某工厂实验室用一种硫酸亚铁样品(含少量硝酸钙)和硫酸铵为原料,设计如下工艺过程,制取硫酸铁铵:
(已知:NaClO、H2O2、KMnO4、K2Cr2O7均具有强氧化性,能氧化Fe2+。)
请完成下列填空:
(1)写出A、B适宜的化学式:A ( ) 、B ( ) 。
(2)减压过滤得到的滤渣C,其主要成分是 ( )(填化学式)。
操作甲的目的是:( ) 。
(3)操作乙、丙的名称分别是:乙( ),丙 ( ) 。
(4)检验产品硫酸铁铵中的阳离子,相关的离子方程式有( )。
(5)为了用重量法确定产品硫酸铁铵[a(NH4)2SO4·bFe2(SO4)3·cH2O]中a、b、c的值(供选用的试剂:浓硫酸、碱石灰、氢氧化钠、氯化钡),除了测得取用样品的质量外,至少还需要测定 种物质的质量。灼烧固体所需要的仪器是( )(选出合适的选项)
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析