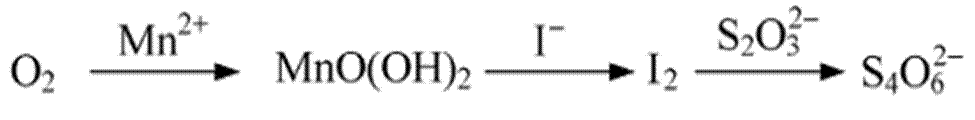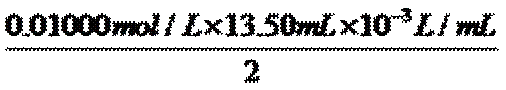- 离子方程式的书写
- 共269题
以磷石膏(只要成分CaSO4,杂质SiO2、Al2O3等)为原料可制备轻质CaCO3。
16.匀速向浆料中通入CO2,浆料清液的pH和c(SO42-)随时间变化见由图。清液pH>11时,CaSO4转化的离子方程式_____________(填序号),能提高其转化速率的措施有 (填序号)
17.当清液pH接近6.5时,过滤并洗涤固体。滤液中物质的量浓度最大的两种阴离子为______和________(填化学式);检验洗涤是否完全的方法是_________。
18.在敞口容器中,用NH4Cl溶液浸取高温煅烧的固体,随着浸取液温度上升,溶液中c(Ca2+)增大的原因___________。
正确答案
解析
磷石膏氨水的浆料中通入二氧化碳可生成碳酸盐或碳酸氢盐,过滤后滤液为硫酸铵、氨水,滤渣含有碳酸钙、SiO2、Al2O3等,高温煅烧生成硅酸钙、偏铝酸钙等,加入氯化铵溶液充分浸取,可生成硅酸、氢氧化铝、氯化钙等,氯化钙最终可生成碳酸钙,
(1)由图象可知,经充分浸取,c(SO42﹣)逐渐增大,pH逐渐减小,清液pH>11时CaSO4生成碳酸钙、铵根离子和硫酸根离子,反应的离子方程式为CaSO4+2NH3•H2O+CO2=CaCO3+2NH4++SO42﹣+H2O或CaSO4+CO32﹣=CaCO3+SO42﹣,为提高其转化速率,可进行搅拌并增大氨水浓度,增大c(CO32﹣),故答案为:CaSO4+2NH3•H2O+CO2=CaCO3+2NH4++SO42﹣+H2O或CaSO4+CO32﹣=CaCO3+SO42﹣;AC;
考查方向
解题思路
磷石膏氨水的浆料中通入二氧化碳可生成碳酸盐或碳酸氢盐,过滤后滤液为硫酸铵、氨水,滤渣含有碳酸钙、SiO2、Al2O3等,高温煅烧生成硅酸钙、偏铝酸钙等,加入氯化铵溶液充分浸取,可生成硅酸、氢氧化铝、氯化钙等,氯化钙最终可生成碳酸钙.
(1)由图象可知,充分浸取,c(SO42﹣)逐渐增大,pH逐渐减小,清液pH>11时CaSO4生成碳酸钙、铵根离子和硫酸根离子;为提高其转化速率,可进行搅拌并增大氨水浓度,增大c(CO32﹣);
易错点
本题以实验流程的形成综合考查化学方程式的书写和化学反应速率的影响因素,侧重于学生的分析能力和实验能力的考查,难度中等,注意把握提给信息以及相关物质的性质.
正确答案
SO42﹣ HCO3﹣ 取少量最后一次的洗涤过滤液与试管中,向其中滴加盐酸酸化的氯化钡溶液,若不产生白色沉淀,则表明已洗涤完全
解析
当清液pH接近6.5时,溶液酸性相对较强,可充分转化生成SO42﹣并有HCO3﹣生成,沉淀吸附SO42﹣,可用盐酸酸化的氯化钡检验,方法是取少量最后一次的洗涤过滤液与试管中,向其中滴加盐酸酸化的氯化钡溶液,若不产生白色沉淀,则表明已洗涤完全,故答案为:SO42﹣;HCO3﹣;取少量最后一次的洗涤过滤液与试管中,向其中滴加盐酸酸化的氯化钡溶液,若不产生白色沉淀,则表明已洗涤完全;
考查方向
解题思路
(2)当清液pH接近6.5时,溶液酸性相对较强,可充分转化生成SO42﹣并有HCO3﹣生成,沉淀吸附SO42﹣,可用盐酸酸化的氯化钡检验;
易错点
本题以实验流程的形成综合考查元素化合物知识,侧重于学生的分析能力和实验能力的考查,难度中等,注意把握提给信息以及相关物质的性质.
正确答案
浸取液温度上升,溶液中氢离子浓度增大,促进固体中钙离子浸出
解析
(3)随着浸取液温度上升,氯化铵水解程度增大,溶液酸性增强,则钙离子浓度增大,故答案为:浸取液温度上升,溶液中氢离子浓度增大,促进固体中钙离子浸出.
考查方向
解题思路
(3)随着浸取液温度上升,氯化铵水解程度增大,溶液酸性增强.
易错点
本题侧重于学生的分析能力和实验能力的考查,难度中等,注意把握提给信息以及相关物质的性质.
烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量。O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:
NO(g)+O3(g)= NO2(g)+O2(g) △H=﹣200.9kJ.mol﹣1
NO(g)+
SO2(g)+O3(g)═SO3(g)+O2(g) △H=﹣241.6kJ.mol﹣1
31.反应3NO(g)+O3(g)=3NO2(g)的△H=_______mol·L-1。
32.室温下,固定进入反应器的NO、SO2的物质的量,改变加入O3的物质的量,反应一段时间后体系中n(NO)、n(NO2)和n(SO2)随反应前n(O3):n(NO)的变化见右图。
①当n(O3):n(NO)>1时,反应后NO2的物质的量减少,其原因是__________。
②增加n(O3),O3氧化SO2的反应几乎不受影响,其可能原因是_________。
33. 当用CaSO3水悬浮液吸收经O3预处理的烟气时,清液(pH约为8)中SO32-将NO2转化为NO2-,其离子方程式为:___________。
34.CaSO3水悬浮液中加入Na2SO4溶液,达到平衡后溶液中c(SO32-)=________[用c(SO42-)、Ksp(CaSO3)和Ksp(CaSO4)表示];CaSO3水悬浮液中加入Na2SO4溶液能提高NO2的吸收速率,其主要原因是_________。
正确答案
﹣317.3
解析
(1)NO(g)+O3(g)═NO2(g)+O2(g)△H=﹣200.9kJ.mol﹣1 ①
NO(g)+
将方程式2②+①3NO(g)+O3(g)=3NO2(g),所以△H=2×(﹣58.2kJ.mol﹣1)+(﹣200.9kJ.mol﹣1)=﹣317.3kJ/mol,故答案为:﹣317.3;
考查方向
解题思路
(1)NO(g)+O3(g)═NO2(g)+O2(g)△H=﹣200.9kJ.mol﹣1①
NO(g)+
易错点
本题考查了盖斯定律等知识点,侧重考查学生分析计算能力,题目难度中等.
正确答案
O3将NO2氧化为更高价态氮氧化物 可能是其反应较慢
解析
(2)①当n(O3):n(NO)>1时,臭氧过量,臭氧具有强氧化性,能将反应后NO2氧化为更高价氮氧化物,导致二氧化氮减少,故答案为:O3将NO2氧化为更高价态氮氧化物;
②增加n(O3),O3氧化SO2的反应几乎不受影响,说明浓度对反应速率影响较小,可能是其反应速率较慢,故答案为:可能是其反应较慢;
考查方向
解题思路
(2)①臭氧具有强氧化性,能氧化生成的NO2;②增加n(O3),O3氧化SO2的反应几乎不受影响,说明浓度对反应速率影响较小,可能是其反应速率较慢;
易错点
本题考查了反应速率影响因素,侧重考查学生分析能力,题目难度中等.
正确答案
SO32﹣+2NO2+2OH﹣=SO42﹣+2NO2﹣+H2O
解析
(3)溶液pH约为8,说明溶液呈碱性,SO32﹣将NO2转化为NO2﹣,同时SO32﹣被氧化生成SO42﹣,根据反应物和生成物书写离子方程式为SO32﹣+2NO2+2OH﹣=SO42﹣+2NO2﹣+H2O,故答案为:SO32﹣+2NO2+2OH﹣=SO42﹣+2NO2﹣+H2O;
考查方向
解题思路
(3)溶液pH约为8,说明溶液呈碱性,SO32﹣将NO2转化为NO2﹣,同时SO32﹣被氧化生成SO42﹣,根据反应物和生成物书写离子方程式;
易错点
本题考查了氧化还原反应离子方程式的书写,题目难度中等.
正确答案

解析
(4)CaSO3水悬浮液中加入Na2SO4溶液,发生反应CaSO3+SO42﹣=CaSO4+SO32﹣,溶液中c(Ca2+)=



考查方向
解题思路
(4)CaSO3水悬浮液中加入Na2SO4溶液,发生反应CaSO3+SO42﹣=CaSO3+SO32﹣,溶液中c(Ca2+)=

易错点
本题考查了溶度积常数计算,侧重考查学生分析计算能力,题目难度中等.
5.下列指定反应的离子方程式正确的是( )
正确答案
解析
A、反应原理错,将铜插入稀硝酸中应为:3Cu+8H++2NO3 -== 3Cu2++2NO↑+4H2O,错误;B、电荷不守恒,向Fe2(SO4)3溶液中加入过量铁粉应为:2Fe3++Fe==3Fe2+,错误;C、向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3﹒H2O==Al(OH)3↓+3NH4+,正确;D、硅酸钠为可溶性盐,用化学式表示,向Na2SiO3溶液中滴加稀盐酸应为:SiO32—+2H+ ==H2SiO3↓,错误。答案选C。
考查方向
解题思路
Al(OH)3不溶于弱酸弱碱。
易错点
判断离子方程式正确与否时不知道从检查反应能否发生、各物质拆分是否正确
、是否符合守恒关系等角度。
知识点
过氧化钙(CaO2·8H2O)是一种在水产养殖中广泛使用的供氧剂。
24.Ca(OH)2悬浊液与H2O2溶液反应可制备CaO2·8H2O。
Ca(OH)2+H2O2+6 H2O=CaO2·8H2O
反应时通常加入过量的Ca(OH)2,其目的是_____________
25.向池塘水中加入一定量的CaO2·8H2O后,池塘水中浓度增加的离子有____________(填序号)。
26.水中溶解氧的测定方法如下:向一定量水样中加入适量MnSO4和碱性KI溶液,生成MnO(OH)2沉淀,密封静置;加入适量稀H2SO4,待MnO(OH)2与I−完全反应生成Mn2+和I2后,以淀粉作指示剂,用Na2S2O3标准溶液滴定至终点,测定过程中物质的转化关系如下:
①写出O2将Mn2+氧化成MnO(OH)2的离子方程式;_____________。
②取加过一定量CaO2·8H2O的池塘水样100.00 mL,按上述方法测定水中溶解氧量,消耗0.01000 mol·L−1 Na2S2O3标准溶液13.50 mL。计算该水样中的溶解氧(用mg·L−1表示),写出计算过程。
正确答案
提高H2O2的利用率
解析
明显在反应中为了提高H2O2的利用率 ,反应中要加入过量的 Ca(OH)。
考查方向
考查如何提高反应物的利用率。
解题思路
增大其中一种反应物的量可以提高另一反应物的转化率。
易错点
不会从利用率的角度去思考。
正确答案
解析
有反应环境状态,反应的体系中一定还有Ca2+和 OH−
考查方向
解题思路
CaO2·8H2O和水反应:2CaO2+2H2O→2Ca(OH)2+O2↑ ; Ca(OH)2电离出Ca2+和 OH−
易错点
不清楚CaO2·8H2O和水反应的反应。
正确答案
①O2+2Mn2++4OH-=MnO(OH)2↓
②在100.00mL水样中
I2+2S2O32-=2I-+S4O62-
n(I2)=
=
=6.750×10-5mol
n[MnO(OH)2]= n(I2)= 6.750×10-5mol
n(O2)= 
水中溶解氧=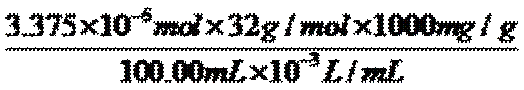
解析
①依题意在碱性条件下O2将Mn2+氧化成MnO(OH)2的离子方程式为:O2+2Mn2++4OH-=MnO(OH)2↓
②在水样中有:I2+2S2O32-=2I-+S4O62-
n(I2)=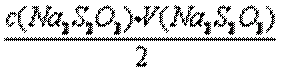
=6.750×10-5moln[MnO(OH)2]= n(I2)= 6.750×10-5mol
n(O2)= 

水中溶解氧=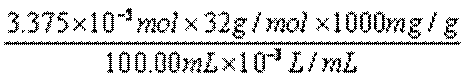
考查方向
解题思路
灵活应用电子得失守恒是解答的关键,电子守恒是氧化还原反应计算的核心思想:得失电子守恒是指在发生氧化还原反应时,氧化剂得到的电子数一定等于还原剂失去的电子数。得失电子守恒法常用于氧化还原反应中氧化剂、还原剂、氧化产物、还原产物的有关计算及电解过程中电极产物的有关计算等。
易错点
计算过程不仔细。
实验室用下图所示装置制备KClO溶液,并通过KClO溶液与Fe(NO3)3溶液的反应制备高效水处理剂K2FeO4。已知K2FeO4具有下列性质①可溶于水、微溶于浓KOH溶液,②在0℃--5℃、强碱性溶液中比较稳定,③在Fe3+和Fe(OH)3催化作用下发生分解,④在酸性至弱碱性条件下,能与水反应生成Fe(OH)3和O2。
27.装置A中KMnO4与盐酸反应生成MnCl2和Cl2,其离子方程式为 ,将制备的Cl2通过装置B可除去 (填化学式)。
28.Cl2和KOH在较高温度下反应生成KClO3,在不改变KOH溶液的浓度和体积的条件下,控制反应在0℃~5℃进行,实验中可采取的措施是_________。
29.制备K2FeO4时,KClO饱和溶液与Fe(NO3)3饱和溶液的混合方式为_______。
30.提纯K2FeO4粗产品[含有Fe(OH)3、KCl等杂质]的实验方案为:将一定量的K2FeO4粗产品溶于冷的3mol·L-1KOH溶液中, ,(实验中须使用的试剂有:饱和KOH溶液,乙醇;除常用仪器外须使用的仪器有:砂芯漏斗,真空干燥箱)。
正确答案
2MnO4﹣+16H++10Cl﹣=2Mn2++5Cl2↑+8H2O HCl
解析
(1)KMnO4具有强氧化性,将盐酸中氯离子氧化为Cl2,反应还有水生成,KMnO4、HCl、MnCl2改写成离子形式,Cl2、H2O为分子式形式,离子方程式为:2MnO4﹣+16H++10Cl﹣=2Mn2++5Cl2↑+8H2O,由于盐酸易挥发,制备的氯气中含有HCl,用饱和食盐水吸收HCl除去,故答案为:2MnO4﹣+16H++10Cl﹣=2Mn2++5Cl2↑+8H2O;HCl;
考查方向
解题思路
(1)KMnO4具有强氧化性,将盐酸中氯离子氧化为Cl2,反应还有水生成,KMnO4、HCl、MnCl2改写成离子形式,Cl2、H2O为分子式形式,配平书写离子方程式;
由于盐酸易挥发,制备的氯气中含有HCl,用饱和食盐水吸收HCl除去;
易错点
本题考查离子方程式的书写,是对学生综合能力的考查,注意题目信息的迁移运用,难度中等.
正确答案
缓慢滴加盐酸、装置C用冰水浴中
解析
(2)Cl2和KOH在较高温度下反应生成KClO3,制取KClO温度反应在0℃~5℃,装置C应放在冰水浴中,充分利用原料,缓慢滴加盐酸,减慢生成氯气的速率,故答案为:缓慢滴加盐酸、装置C用冰水浴中;
考查方向
解题思路
(2)Cl2和KOH在较高温度下反应生成KClO3,制取KClO温度反应在0℃~5℃,装置C应放在冰水浴中,充分利用原料,应降低通入氯气的速率;
易错点
本题考查实验制备方案、对条件与操作的分析评价、阅读获取信息能力,是对学生综合能力的考查,注意题目信息的迁移运用,难度中等.
正确答案
在搅拌下,将Fe(NO3)3饱和溶液缓慢滴加到KClO 饱和溶液中
解析
(3)K2FeO4在Fe3+和Fe(OH)3催化作用下发生分解,应把Fe(NO3)3饱和溶液滴加到KClO溶液中,具体操作为:在搅拌下,将Fe(NO3)3饱和溶液缓慢滴加到KClO 饱和溶液中,故答案为:在搅拌下,将Fe(NO3)3饱和溶液缓慢滴加到KClO 饱和溶液中;
考查方向
解题思路
(3)K2FeO4在Fe3+和Fe(OH)3催化作用下发生分解,应把Fe(NO3)3饱和溶液滴加到KClO溶液中;
易错点
本题考查实验制备方案、对条件与操作的分析评价、阅读获取信息能力,是对学生综合能力的考查,注意题目信息的迁移运用,难度中等.
正确答案
用砂芯漏斗过滤,将滤液置于冰水浴中,向滤液中加入饱和的KOH溶液,再用砂芯漏斗过滤,晶体用乙醇洗涤2﹣3次后,在真空干燥箱中干燥
解析
(4)提纯K2FeO4粗产品[含有Fe(OH)3、KCl等杂质]的实验方案为:将一定量的K2FeO4粗产品溶于冷的3mol•L﹣1KOH溶液中,用砂芯漏斗过滤,将滤液置于冰水浴中,向滤液中加入饱和的KOH溶液,再用砂芯漏斗过滤,晶体用乙醇洗涤2﹣3次后,在真空干燥箱中干燥,故答案为:用砂芯漏斗过滤,将滤液置于冰水浴中,向滤液中加入饱和的KOH溶液,再用砂芯漏斗过滤,晶体用乙醇洗涤2﹣3次后,在真空干燥箱中干燥.
考查方向
解题思路
(4)用砂芯漏斗过滤,除去氢氧化铁,由于K2FeO4可溶于水、微溶于浓KOH溶液,将滤液置于冰水浴中,向滤液中加入饱和的KOH溶液,析出K2FeO4晶体,再进行过滤,用乙醇洗涤,减少因溶解导致晶体损失,最后在真空干燥箱中干燥.
易错点
本题考查实验制备方案、物质的分离提纯、对条件与操作的分析评价、阅读获取信息能力,是对学生综合能力的考查,注意题目信息的迁移运用,难度中等.
扫码查看完整答案与解析