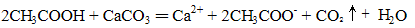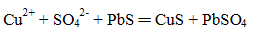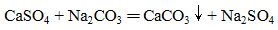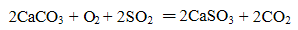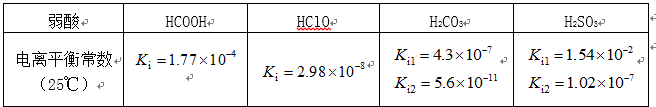- 离子方程式的书写
- 共269题
下列化学(或离子)方程式不正确的是
正确答案
解析
略
知识点
下列离子方程式书写正确的是
正确答案
解析
略
知识点
下列解释事实的化学方程式或离子方程式不正确的是
正确答案
解析
略
知识点
下列解释事实的化学方程式或离子方程式,不正确的是
正确答案
解析
略
知识点
下列离子方程式书写正确的是 ( )
正确答案
解析
略
知识点
下列离子方程式书写正确的是
正确答案
解析
略
知识点
废旧铅蓄电池的回收利用是发展循环经济的必经之路。其阴、阳极填充物(铅膏,主要含PbO、PbO2、PbSO4)是废旧铅蓄电池的主要部分,回收时所得黄丹(PbO)、碳酸铅可用于合成三盐基硫酸铅(组成可表示为3PbO·PbSO4·H2O),其工艺流程如下:
(1)用碳酸盐作转化剂,将铅膏中的硫酸铅转化为碳酸铅,写出转化反应方程式:
(2)滤液A能用来回收Na2SO4·10H2O,提取该晶体的主要步骤有____________、___________、过滤、洗涤、干燥;检验该晶体中阴离子的实验方法是________ ____。
(3)物质X是一种可循环使用的物质,其溶质主要是______________(填化学式),若X中残留的 
(4)生成三盐基硫酸铅的离子方程式为____________________。
(5)向铅膏浆液中加入Na2SO3溶液的目的是将其中的PbO2还原为PbO。若实验中所取铅膏的质量为47。8g,其中PbO2的质量分数为15%,则要将PbO2全部还原,至少需要加入______mL的0.5 mol/LNa2SO3溶液。
正确答案
(1)PbSO4(s)+


(2)蒸发浓缩 、冷却结晶 (2分) 取少量晶体溶于蒸馏水,然后用盐酸酸化,再滴BaCl2溶液,若出现白色沉淀,即证明该晶体中含有SO42- (2分)
(3)HNO3(2分) 浸出时部分铅离子生成PbSO4随浸出渣排出,降低PbSO4的产率(2分)
(4)4 PbSO4 + 6OH- =3 PbO•PbSO4•H2O + 3 SO42- + 2 H2O (3分)
(5) 60(3分)
解析
略
知识点
部分弱酸的电离平衡常数如下表:
(1)在温度相同时,各弱酸的Ki值与酸性的相对强弱的关系为:________________________。
(2)下列离子方程式正确的是
A,2ClO- + H2O + CO2 → 2HClO + CO32-
B,2HCOOH + CO32- → 2HCOO- + H2O + CO2↑
C,H2SO3 + 2HCOO- → 2HCOOH + SO32-
D,Cl2 + H2O+2CO32- → 2HCO3- + Cl- + ClO-
(3)常温下,pH=3的HCOOH溶液与pH=11的NaOH溶液等体积混合后,溶液中离子浓度由大到小的顺序为 。
亚硒酸(H2SeO3)也是一种二元弱酸,常温下是一种无色固体,易溶于水,有较强的氧化性。
(4)往亚硒酸溶液中不断通入SO2 会产生红褐色单质,写出该反应的化学方程式: 。
(5)将亚硒酸与30%的H2O2加热可制得硒酸(H2SeO4),反应方程式如下:
H2SeO3 + H2O2 → H2SeO4+H2O,下列说法中正确的是
A,H2O2既是氧化剂又是还原剂
B,H2O 既不是氧化产物又不是还原产物
C,H2SeO4既是氧化产物又是还原产物
D,氧化性:H2SeO3>H2SeO4
碲酸(H6TeO6)是一种很弱的酸,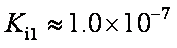
HI+ H6TeO6
(6)若反应中生成的TeO2与Te的物质的量之比为
正确答案
(1)Ki值越大,酸性越强
(2)BD
(3)C(HCOO—)>C(Na+)>C(H+)>C(OH—)
(4)H2SeO3 + 2SO2 +H2O → Se ↓+ 2H2SO4
(5)C
(6)8HI + 2H6TeO6 → TeO2 + Te +4I2 + 10H2O
解析
略
知识点
下列有关反应的化学方程式或离子方程式正确的是( )
正确答案
解析
略
知识点
下列条件下,离子能大量共存或者离子方程式正确的是
正确答案
解析
略
知识点
扫码查看完整答案与解析