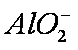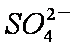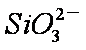- 离子方程式的书写
- 共269题
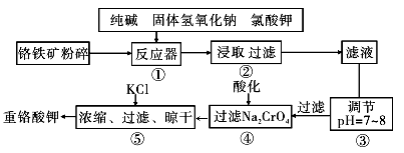
重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3,杂质为SiO2、Al2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下图。涉及的主要反应是: 6FeO·Cr2O3+24NaOH+7KClO3=12Na2CrO4+3Fe2O3+7KCl+12H2O。
(1)碱浸前将铬铁矿粉碎的目的是________。
(2)步骤③调节pH后过滤得到的滤渣是________。
(3)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式________。
(4)用简要的文字说明操作⑤加入KC1的原因________________。
(5)目前处理酸性Cr2O72-废水多采用铁氧磁体法。该法是向废水中加入FeSO4 ·7H2O将Cr2O72-还原成Cr3+,调节pH,Fe、Cr转化成相当于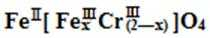
A. x =0.5 ,a =8
B. x =0.5 ,a = 10
C. x = 1.5 ,a =8
D. x = 1.5 ,a = 10
正确答案
(1)增大接触面积,增大反应速率。
(2)Al(OH)3;H2SiO3
(3)2CrO42-+2H+ 
(4)温度对氯化钠的溶解度影响小,但对重铬酸钾的溶解度影响较大,利用复分解反应可以得到重铬酸钾。
(5)D
解析
略。
知识点
下列离子方程式的书写正确的是
正确答案
解析
略
知识点
下列离子方程式书写正确的是( )
正确答案
解析
略
知识点
高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂。工业上可以通过次氯酸钠氧化法制备高铁酸钠,生产过程如下:
回答下列问题:
(1)氢氧化钠的电子式是________。
(2)经过步骤①后,加入NaOH固体的原因是________。
(3)步骤②反应的离子方程式是________。
(4)从溶液Ⅰ中分离出Na2FeO4后,还有副产品Na2SO4 、NaCl,则步骤③中反应的离子方程式为________。
(5)将一定量的Na2FeO4投入到pH不同的污水中(污水中其余成分均相同),溶液中Na2FeO4浓度变化如下图曲线Ⅰ、Ⅱ所示,试推测曲线I比曲线II对应的污水pH
________(填“高”或“低”)。
(6)通过计算得知Na2FeO4的消毒效率(以单位质量得到的电子数表示)比氯气的_____(填“高”或“低”),用高铁酸钠代替氯气作净水消毒剂的优点是_____(答出两点即可)。
正确答案
见解析。
解析
(1)
(2)Na2FeO4只在碱性环境中稳定存在,所以加入氢氧化钠可以调节溶液显碱性
(3)2Fe2+ + H2O2 + 2H+ = 2Fe3+ + 2H2O
(4)2Fe3+ + 3ClO- + 10OH- = 2FeO42- + 3Cl- + 5H2O
(5)高
(6)低 , 既能消毒杀菌又能净水(或无毒或方便保存等)
知识点
下列根据实验操作及其现象描述所写离子方程式正确的是
正确答案
解析
略
知识点
根据下表提供的数据,下列判断正确的是
正确答案
解析
略
知识点
藏硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,僵使用过量会使人中毒,国酥上对食品中亚硝酸钠的用量控制在很低的本平上。某学习小组针对亚硝酸钠设计了如下实验:
该小组查阅资料知: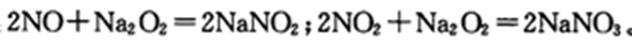
(1)装置D可将剩余的NO氧化成N03,发生反应的离子方程式为____。
(2)如果没有B装置,C中发生的副反应有____。
(3)甲同学梭在完气密往良好后进行实验,发现NaNO2的纯度较低。乙简学对上述装置进行了改进后提高了NaNO2的纯度,其改进措施是____。
(4)丙同学撩B中的药品进行了更换,也提高了NaNO2鲍纯度。丙更换的药最是 。
【实验Ⅱ】测定甲、乙同学制取样晶中NaNO2的含量
步骤:a,在5个有编号的带刻度试管(比色管)中分别加入不同量的
b,分别称量0。10 g甲、乙制得的样品溶于水配成500 mL溶液,贴上标签甲、乙。再分离别取5 mL甲、乙待测液,各加入1 mL M溶液,均加蒸馏水至10 mL振荡,分别与标准色阶比较。
(5)步骤b中比较结果是:甲待测液颜色与③号色阶相同,乙待测液颜色与④号色阶相同。则甲同学制得的样品中NaN02的纯度是____%。
(6)用目视比色法证明维生素C可以有效降低NaNO2的含量。设计并完成下列实验报告。
正确答案
(1)5NO +3MnO4-+4H+ = 5NO3-+3Mn2++2H2O(2分)
(2)2Na2O2+ 2H2O = 4NaOH+O2↑(1分) 2NO + O2= NO2(1分)
(3)在A、B之间增加装有水的洗气瓶(2分)
(4)碱石灰或氧化钙(2分)
(5)40(2分)
(6)实验方案:取5mL甲待测液加入维生素C,振荡,再加入1 mL M溶液,加入蒸馏水至10mL(1分,“取5mL甲待测液”、“加入维生素C”、“加入1 mL M溶液”、“加入蒸馏水至10mL”四个要点,答出三个以上得1分);再振荡,与③号色阶对比(1分)。
实验现象:紫红色比③色阶浅(1分)。
解析
略
知识点
下列反应的离子方程式书写正确的是
正确答案
解析
略
知识点
水是生命之源,也是人类最宝贵的资源。饮用水的制取通常包括:混凝沉淀、杀菌消毒、硬水软化等过程。
(1)生活中人们常用明矾来作净水剂,除去水中的悬浮物。请用离子方程式表示明矾净水的原理____。
(2)ClO2是国际上通用的饮用水消毒剂。科学家用硫酸酸化的草酸(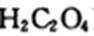
(3)高铁酸钾(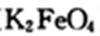
(4)硬水的软化通常有药剂法、离子交换法等。
①某学习小组用生石灰和纯碱软化硬水的工艺流程图如下:
试剂a箍____;沉淀M是 (写化学式);加入试剂b后生成沉淀的离子方程式为____。
②离子交换法是用阳离子交换树脂(HR)和水中的金属离子Mn+进行交换的一种方法。写出用HR软化硬水的相关离子方程式 。
(5)某同学欲对用ClO2消毒过的水进行CI-含量的测定,实验过程如下:向30.00 mL水样中加几滴K2ClO4溶液作指示剂,用0.001000 mol.L-l AgN溶液滴定,当有砖红色Ag2CrO4沉淀出现时,达到滴定终点,此时用去籼辩毡溶液12.12 nlL。则水样中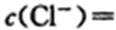
正确答案
(1)Al3+ + 3 H2O 
(2)H2C2O4+2NaClO3+H2SO4 = Na2SO4+2CO2↑+2ClO2↑+2H2O(2分)
(3)高铁酸钾中铁为高价,有强氧化性,具有杀菌作用;高铁酸钾被水中还原性物质还原,生成的Fe3+水解产生Fe(OH)3 ,具有吸附作用。(2分)
(4)①CaO (1分) Mg(OH)2 (2分) Ca2++CO32+ = CaCO3↓(2分)
②2HR + Ca2+ = CaR2 + 2H+(1分) 2HR +Mg2+ = MgR2 + 2H+(1分)
(5)4.04×10 -4 mol·L-1 (2分)
解析
略
知识点
下列离子方程式与所述事实相符的是
正确答案
解析
略
知识点
扫码查看完整答案与解析