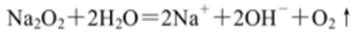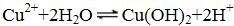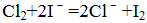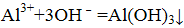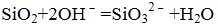- 离子方程式的书写
- 共269题
某化学兴趣小组用只含有铝、铁、铜的工业废料制取纯净的氯化铝溶液、绿

(1)写出合金与烧碱溶液反应的离子方程式: 。
(2)由滤液A制Al
(3)滤液E若放置在空气中一段时间后,溶液中的阳离子除了

(用离子符号表示),检测该离子的方法是 。
(4)用滤渣F通过两种途径制取胆矾,与途径③相比,途径④明显具有的两个优点是: 。
(5)途径④发生的反应的化学方程式为: 。
(6)实验室从CuSO4溶液制取胆矾,操作步骤有蒸发浓缩、冷却结晶、 、自然干燥。
正确答案
(1)2Al +2OH― + 2H2O → 2AlO2― +3H2↑
(2)
(3)Fe3+ 取样,滴加KSCN,若变血红色,则有Fe3+ 。
(4)成本低 ;不产生有毒气体
(5)2Cu +2H2SO4 +O2 → 2CuSO4 +2H2O
(6)过滤洗涤
解析
略
知识点
室温时,盐酸和硫酸的混合溶液20mL,向混合物中逐滴加入0.05mol/L Ba(OH)2溶液时,生成的BaSO4和pH的变化如图所示(不考虑溶液混合时体积的变化)。下列说法正确的是
正确答案
解析
略
知识点
下列说法中正确的是
正确答案
解析
略。
知识点
下列有关反应的离子方程式正确的是
正确答案
解析
略
知识点
以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(
(1)氧化过程中发生反应的离子方程式是_________,检验氧化生成的阳离子的试剂是_________。
(2)尾气中主要含

方案一:让尾气缓慢通过以下装置。
①C仪器的名称是_________,该装置的作用是_________。
②实验时先通入尾气,再通入一定量氮气。若通过B装置的增重来测量SO2的体积分数。你认为该方案是否合理_________,请说明理由_________(若方案合理该空不必填写)。
方案二:将尾气缓慢通过足量溴水,在所得的溶液中加入过量氯化钡溶液后,过滤,将沉淀洗涤、干燥,称得其质量为mg。
①加入过量氯化钡溶液的目的是_________。
②进行沉淀洗涤的方法是_________。
③SO2含量的表达式是_________(用含m、V的代数式表示)。
(3)从FeCl3溶液中得到FeCl3·6H2O晶体的操作包括_________、冷却结晶、过滤,该过程需保持盐酸过量,结合必要的离子方程式说明原因_________。
正确答案
(1)2Fe2+ + Cl2= 2Cl- + 2Fe3+;KSCN溶液
(2)方案一:①干燥管;防止空气中的水蒸气、CO2被B装置吸收;②否;尾气中的CO2也能被B装置吸收使所测质量分数偏大;方案二:①使生成的SO42-完全转化为沉淀;②在漏斗中加蒸馏水至恰好没过沉淀,待水流下后再重复2~3次此操作;③
(3)蒸发浓缩;Fe3+ + 3H2O 
解析
略。
知识点
解释下列事实的方程式正确的是
正确答案
解析
略
知识点
甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究。
(1)B中反应的离子方程式是______。
(2)A中溶液变红的原因是______。
(3)为了探究现象II的原因,甲同学进行如下实验。
①取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在_______。
②取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液。
甲同学的实验证明产生现象II的原因是SCN—与Cl2发生了反应。
(4)甲同学猜想SCN—可能被Cl2氧化了,他又进行了如下研究。
资料显示:SCN—的电子式为 
①甲同学认为SCN—中碳元素没有被氧化,理由是______。
②取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN—中被氧化的元素是______。
③通过实验证明了SCN—中氮元素转化为,他的实验方案是______。
④若SCN—与Cl2反应生成1 mol CO2,则转移电子的物质的量是______mol。
正确答案
见解析。
解析
(1)Cl2+2OH— === Cl—+ClO—+ H2O
(2)Fe2+被Cl2氧化生成Fe3+,Fe3+与SCN—反应生成红色的,所以溶液变红
(3)①Fe3+
(4)①SCN—中的碳元素是最高价态+4价
②硫元素
③取足量铜粉于试管中,加入A中黄色溶液和一定量的稀盐酸,加热,观察到试管上方有红棕色气体生成,证明A中存在,SCN—中氮元素被氧化成
④16
知识点
下列离子方程式不正确的是
正确答案
解析
略
知识点
卤素单质及其化合物在生产和生活中有广泛应用。
Ⅰ、氟化钠主要用作农作物杀菌剂、杀虫剂、木材防腐剂。实验室以氟硅酸(
已知:20℃时氯化铵的溶解度为37.2 g,氟化钠的溶解度为4 g,Na2SiF6微溶于水。
请回答下列有关问题:
(1)完成并配平上述流程中①、②的化学反应方程式:
② 。
(2)操作Ⅲ分为两步,其顺序是 (填写所选序号)。
a、过滤 b、加热浓缩 c、冷却结晶 d、洗涤
操作Ⅱ是洗涤、干燥,其目的是 ,在操作Ⅰ~V中与之相同的操作步骤是 。
(3)流程①中NH4HCO3必须过量,其原因是 。
Ⅱ、紫菜与海带类似,是一种富含生物碘的海洋植物,可用于食用补碘。以下为某兴趣小组模拟从紫菜中提取碘的过程:
已知:商品紫菜轻薄松脆,比海带更易被焙烧成灰(此时碘转化为碘化物无机盐)。
(4)将焙烧所得的紫菜灰与足量的双氧水和稀硫酸作用,写出反应的离子方程式:
。
(5)操作①中涉及两步操作,名称是 ,所用的主要玻璃仪器为 ,所用试剂A最好选用表格中的 (填试剂名称)。
(6)将下列装置图中缺少的必要仪器补画出来,以最终将单质碘与试剂A分离:
正确答案
(1)
(2)be(1分) ; 除去氟化钠表面的氯化铵等可溶性杂质(1分) ; V(1分)
(3)使氟硅酸完全反应,避免析出Na2SiFe而混入杂质(1分)
(4)
(5)过滤;烧杯;碘
(6)
解析
略
知识点
下列解释事实的离子方程式不正确的是
正确答案
解析
略
知识点
扫码查看完整答案与解析