- 化学反应原理
- 共2396题
下列各组物质由于温度不同而能发生不同氧化还原反应的是
正确答案
解析
略
知识点
7.已知可用








正确答案
解析
解析已在路上飞奔,马上就到!
知识点
10.以Pt为电极,电解含有金属离子



正确答案
解析
解析已在路上飞奔,马上就到!
知识点
7. 常温下,在溶液中可以发生反应:
①X被氧化 ②X是氧化剂 ③X具有还原性
④



正确答案
解析
解析已在路上飞奔,马上就到!
知识点

2Fe2++H2O2+2H+=2Fe3++2H2O 2Fe3++H2O2=2Fe2++O2↑+2H+下列说法错误的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
13.一细束含有红光和紫光的复色光,从空气斜射入水中,分成a、b两束单色光,测得它们在水中的传播速度va>vb,则下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
8.已知:
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
12.根据表中信息判断,下列选项不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
7. 以油类为溶剂的防锈漆称为油基防锈漆,由于环保方面的原因,目前要推广使用水基防锈漆,但水基漆较易溶解O2,在干燥之前易导致金属表面产生锈斑,为此要在水基漆中加入缓蚀剂,以下不可作为缓蚀剂的是:()
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28.某研究性学习小组为探究Cl2的氧化性和I-的还原性强于Fe2+,设计了下图装置制取Cl2,并进行实验探究。回答下列问题:
(1)仪器A的名称:( );用仪器B代替分液漏斗的目的是( );
(2)制取Cl2方法有多种:
①用MnO2加热条件下氧化浓盐酸;
②用KMnO4常温下氧化浓盐酸;
③用O2在450℃,催化剂氧化浓盐酸;
三种氧化剂氧化性由强到弱的顺序为:( );
只用该装置应选用方法是(用离子方程式表示): ( ) ;
(3)为比较I-和Fe2+的还原性强弱,需在甲瓶中滴几滴淀粉试液,目的是( );在乙瓶中滴几滴KSCN试液,目的是( ) ;能得出I-还原性强于Fe2+的实验依据是 ( );
(4)该实验设计最大的缺陷是 ( ) ;
(5)当乙瓶中c(Fe2+)=C(Fe3+),瓶内反应的离子方程式为:( ) ;标准状况下乙瓶中通入Cl2体积理论上至少应为( ) L。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
13.O2F2可以发生反应:H2S+4O2F2→SF6+2HF+4O2,下列说法正确的是
正确答案
解析
A. O元素的化合价由反应前的+1价变为反应后的0价,化合价降低,获得电子,所以氧气是还原产物,错误; B. 在反应中O2F2中的O的化合价降低,获得电子,所以该物质是氧化剂,而H2S中的S元素的化合价是-2价,反应后变为SF6中的+6价,所以H2S是还原剂,错误; C.外界条件不明确,不能确定HF的物质的量,所以不能确定转移电子的数目,错误; D.根据方程式可知还原剂H2S与氧化剂O2F2的物质的量的比是1:4,,正确。
考查方向
解题思路
O2F2中O的化合价为+1,SF6中S的化合价为+6.
易错点
在反应中元素的化合价发生的变化分析出现错误。
知识点
8.给定条件下,下列选项中所示的物质间转化均能一步实现的是( )
正确答案
解析
A.Si可与氯气在高温下反应生成SiCl4,SiCl4可与氢气发生反应生成Si和HCl,该反应可用于工业提纯硅,故A正确;B.电解氯化镁溶液生成氢氧化镁、氯气和氢气,工业用电解熔融的氯化镁制备镁,故B错误;C.氯化铁易水解,加热溶液生成氢氧化铁和HCl,蒸发时应在HCl环境中进行,故C错误;D.蔗糖为非还原性糖,与银氨溶液不反应,故D错误.故选A.
考查方向
解题思路
A.Si可与氯气在高温下反应生成SiCl4,SiCl4可与氢气发生反应生成Si和HCl;B.电解氯化镁溶液生成氢氧化镁、氯气和氢气;C.氯化铁易水解,加热溶液生成氢氧化铁和HCl;D.蔗糖为非还原性糖,与银氨溶液不反应.
易错点
本题综合考查元素化合物知识,侧重于学生的分析能力的考查,注意把握物质的性质以及转化的特点、反应条件,难度不大,注意相关基础知识的积累.
知识点
9.下列各项中,理由、结论及因果关系均正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
(1)磷、硫元素的单质和化合物应用广泛。
1)磷元素的原子结构示意图是____________。
2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2=6CaSiO3+P4O10 10C+P4O10=P4+10CO
每生成1 mol P4时,就有________mol电子发生转移。
3)硫代硫酸钠(Na2S2O3)是常用的还原剂。在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C完全氧化,剩余的I2用Na2S2O3溶液滴定,可测定溶液中维生素C的含量。发生的反应为:
C6H8O6+I2=C6H6O6+2H++2I- 2S2O32-+I2=S4O62-+2I-
在一定体积的某维生素C溶液中加入a mol·L-1 I2溶液V1 mL,充分反应后,用Na2S2O3溶液滴定剩余的I2,消耗b mol·L-1 Na2S2O3溶液V2 mL。该溶液中维生素C的物质的量是__________mol。
4)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:
2IO3-+5SO32-+2H+=I2+5SO42-+H2O
生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。某同学设计实验如下表所示:
该实验的目的是_____________;表中V2=___________mL。
(2)、稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位。
5)铈(Ce)是地壳中含量最高的稀土元素。在加热条件下CeCl3易发生水解,无水CeCl3可用加热CeCl3·6H2O和NH4Cl固体混合物的方法来制备。其中NH4Cl的作用是______________。
6)在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离。完成反应的离子方程式:
____Ce3++____H2O2+____H2O =____Ce(OH)4↓+____ _______
正确答案
见解析。
解析
1)写出P原子的结构示意图: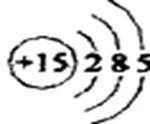
2)每生成1 mol P4时,P由+5价变成0价,电子转移为5×4=20或C化合价由0价变成为+2价,电子转移为2×10=20;
3)n(Na2S2O3)=bV1/1000 mol;与其反应的I2为bV1/2000 mol,与维生素C反应的I2为 
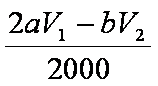
4)由实验2可以看出混合液的总体积为50mL,V1为10mL,V2为40mL,实验1和实验2可知实验目的是探究该反应速率与亚硫酸钠溶液浓度的关系;实验2和实验3可知实验目的是探究该反应速率与温度的关系。
5)题目中给出:“加热条件下CeCl3易发生水解”,可知NH4Cl的作用是肯定是抑制水解的,CeCl3水解会生成HCl,可以完整答出:NH4Cl的作用是分解出HCl气体,抑制CeCl3水解。
6)根据题意:“强酸性”或观察方程式可知缺项是H+,利用电子得失守恒或观察法就可以配平方程式。2Ce3++H2O2+6H2O= 2Ce(OH)4↓+6H+
知识点
6.对下列四幅图的描述正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析