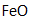- 化学反应原理
- 共2396题
下列说法正确的是
正确答案
解析
略
知识点
工业上,以钛铁矿为原料制备二氧化钛的工艺流程如下图所示。钛铁矿主
要成分为钛酸亚铁(FeTiO3),其中一部分铁元素在风化过程中会转化为+3价。
已知:TiOSO4遇水会水解。
(1)步骤②中,用铁粉将Fe3+转化为Fe2+的反应的离子方程式为 。
(2)步骤③中,实现混合物的分离是利用物质的 (填字母序号)。
a. 熔沸点差异
b. 溶解性差异
c. 氧化性、还原性差异
(3)步骤②、③、④中,均需用到的操作是 (填操作名称)。
(4)请结合化学用语用化学平衡理论解释步骤④中将TiO2+转化为H2TiO3的原理:
。
(5)可以利用生产过程中的废液与软锰矿(主要成分为MnO2)反应生产硫酸锰
(MnSO4,易溶于水),该反应的离子方程式为 。
(6)研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用下图所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛。
①写出阳极所发生反应的电极反应式: 。
②在制备金属钛前后,CaO的总量不变,其原因是(请结合化学用语解释) 。
正确答案
见解析。
解析
(1)2Fe3+ + Fe === 3Fe2+
(2)b
(3)过滤
(4)溶液中存在平衡:TiO2+ + 2H2O 
平衡正向移动,生成H2TiO3。
(5)MnO2 + 2Fe2+ + 4H+ === Mn2+ + 2Fe3+ + 2H2O
(6)① 2O2- - 4e- == O2↑
或 C + 2O2- - 4e- == CO2↑
②制备TiO2时,在电解槽发生如下反应:
由此可见,CaO的量不变。
或: 制备TiO2时,在电解槽发生如下反应:
阴极:2Ca2+ + 4e- == 2Ca
阳极:2O2- - 4e- == O2↑
由此可见,CaO的量不变。
知识点
下列有关物质的性质和该性质的应用均正确的是
正确答案
解析
略
知识点
下图是研究铁钉腐蚀的装置图,下列说法不正确的是
正确答案
解析
略
知识点
下列说法不正确的是( )
正确答案
解析
试题分析:明矾净水利用的正是水解产生的氢氧化铝有吸附性而净水的,A正确;在海轮外壳上镶上锌块,利用的是牺牲阳极的电化学保护法减缓船体腐蚀,B正确;热的纯碱促进水解,碱性增强,去油污效果增强,C正确;工业实际生产金属镁是通过电解熔融的氯化镁来制备的,氧化镁的熔点高,不适合在熔融下制备金属镁,D错误;故选D。
知识点
铁、铝及其化合物在生产和生活中有着广泛的应用。
(1)某研究性学习小组设计了如下图所示装置探究钢铁的腐蚀与防护。
在相同条件下,三组装置中铁电极腐蚀最快的是_________(填装置序号),该装置中 正极电极反应式为___________;为防止金属Fe被腐蚀,可以采用上述__________(填装置序号)装置原理进行防护;装置③中总反应的离子方程式为_____________。
(2)新型固体LiFePO4隔膜电池广泛应用于电动汽车。
电池反应为FePO4+Li
(3)为治理某河流的镉(Cd2+)污染,工作人员先向河中投入沉淀剂将Cd2+转化为难溶物,再投入氯化铝,试说明氯化铝的作用___________(用必要的离子方程式和文字进行解释)。
正确答案
(1)① 
2Cl-+2H2O
(2)正
(3)氯化铝溶于水,

解析
略。
知识点
下列关于电化学的实验事实正确的是
正确答案
解析
略
知识点
下列实验,能达到实验目的的是
正确答案
解析
略。
知识点
出土的锡青铜(铜锡合金)文物常有Cu2(OH)3Cl覆盖在其表面。下列说法错误的是( )
正确答案
解析
略
知识点
下列说法中正确的是
正确答案
解析
略
知识点
下列叙述正确的是
正确答案
解析
略。
知识点
如图所示的钢铁腐蚀中,下列说法正确的是
正确答案
解析
略
知识点
由熔盐电解法获得的粗铝含有一定量的金属钠和氢气,这些杂质可采用吹气精炼法除去,产生的尾气经处理后可用钢材镀铝。工艺流程如下:
(注
(1)工业上电解法获得金属铝的过程中,须在氧化铝中加入_______ ,其目的是 ___________ 。
(2)精炼前,需清除坩埚内的氧化铁和石英砂,防止精炼时它们分别与铝发生置换反应产生新的杂质,铝与氧化铁反应的化学方程式为: _____________________ 。
(3)将Cl2连续通入粗铝熔体中,杂质随气泡上浮除去。气泡的成分有 _________;固态杂质粘附于气泡上,在熔体表面形成浮渣,浮渣中的物质有 ________________- 。
(4)在用废碱液处理A时,写出主要反应的离子方程式___________________ 。
(5)镀铝电解池中,以钢材镀件和铝为电极,熔融盐做电解液。则金属铝为 ________ 极。电镀选择在170℃下进行的原因是 __________________ 。采用的加热方式最好是 ________ 。(填字母选项)
A、水浴 b、油浴 c、直接强热快速升温至170℃
(6)钢材表面镀铝之后,能有效防止钢材腐蚀,其原因是_____________ 。
正确答案
(1)冰晶石或Na3AlF6,降低氧化铝熔融所需的温度。
(2)2Al+Fe2O3
(3)Cl2、HCl和AlCl3; NaCl
(4)Cl2+2OH— → Cl— + ClO— + H2O H+ + OH- → H2O
(5)阳极,防止氯化铝升华损失, b
(6)铝在钢材表面形成致密的氧化铝膜,保护了内层金属。
解析
略
知识点
下列图示内容的对应说明错误的是
正确答案
解析
略
知识点
图Ⅰ的目的是精炼铜,图Ⅱ的目的是保护钢闸门。下列说法不正确的是
正确答案
解析
略
知识点
扫码查看完整答案与解析