- 化学反应原理
- 共2396题
27.节能减排是当今社会的热门话题,研发混合动力汽车对于中国汽车业的未来具有重要的战略意义。混合动力汽车持续工作时间长,动力性好的优点,无污染、低噪声的好处,汽车的热效率可提高10%以上,废气排放可改善30%以上,某种混合动力汽车的动力系统由“1.6L汽油机十自动变速器十20kW十200V镍氢电池”组成。
①混合动力汽车所用的燃料之一是乙醇,lg乙醇完全燃烧生成CO2气体和液态H2O放出30.0kJ热量,写出乙醇燃烧的燃烧热的热化学方程式( )。

③常温下,同浓度的Na2CO3溶液和NaHCO3溶液的pH都大于7,两者中哪种的pH更大,其原因是 ( )。0.1mol·L-1 Na2CO3中阴高子浓度大小关系是( ),向0.1mol·L-1 Na2CO3溶液中滴入少量氢氧化钡溶液,则发生反应的离子方程式为:( )。
(2)二氧化锰、锌是制备干电池的重要原料,工业上用软锰矿(含MnO2)和闪锌矿(含ZnS)
联合生产二氧化锰、锌的工艺如下:
①操作Ⅰ需要的玻璃仪器是( ) 。
②软锰矿(含MnO2)和闪锌矿与硫酸反应的化学方程式为( ),上述电解过程中,当阴极生成6.5g B时阳极生成的MnO2的质量为( ) 。
③利用铝热反应原理,可以从软锰矿中提取锰,发生的化学方程式为( ) 。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
13. 用惰性电极电解某金属元素R的硝酸盐R(NO3)n溶液,通电一段时间后,阳极产生气体V L(标准状况)时,阴极质量增加m g,若R的相对原子质量为M,设NA 为阿伏加德罗常数的值,下列叙述中不正确的是()
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
13.室温下,取m克铝镁合金与一定浓度的稀硝酸恰好完全溶解(假定硝酸的还原产物只有NO),向反应后的混合溶液中滴加b mol/L NaOH溶液,当滴加到V mL时,得到沉淀质量恰好为最大值n克,则下列有关该实验的说法中正确的有( )
①沉淀中氢氧根的质量为(
②恰好溶解后溶液中的NO3—离子的物质的量为
③反应过程中转移的电子数为
④生成NO气体的体积为
⑤发生反应的硝酸的物质的量为(
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
9.a mol Cu与含b mol HNO3的溶液恰好完全反应,被还原的HNO3的物质的量一定是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
33.化学实验有助于理解化学知识,形成化学观念,提高探究与创新能力,提升科学素养。
(1)在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关实验。写出制取Cl2的离子方程式( );某小组要从该混合物中回收MnO2并提取MnCl2晶体,则要多次用到的玻璃仪器是( )。
(2)下图A~G都是常见的与气体制备、收集、尾气吸收有关的装置。例如,B、C都可以收集H2、CH4、NH3、Cl2等。如果收集Cl2并进行尾气处理,不能选用 ( );如用B收集Cl2,应该从( )(甲、乙)端进气。
(3)工业常用Cl2从海水中制备Br2,反应离子方程式是( ) 。实验室模拟该实验,分离出Br2的操作是:取混合溶液于分液漏斗中,加入CCl4,振荡 ,静置分层,( ) 。
(4)次氯酸盐有强氧化性,如NaClO 可以氧化NH3制备高能燃料N2H4,反应方程式是:(
)。现有14.9g NaClO 最多可以制备( )mol N2H4。





正确答案
(1)
(2)DF ; 乙
(3)
(4)
解析
解析已在路上飞奔,马上就到!
知识点
26.铜及其化合物在生产、生活中有广泛的应用。
Ⅰ、铜可采用如下方法制备:
方法一:火法炼铜:Cu2S + O2 2Cu + SO2
方法二:湿法炼铜: CuSO4 + Fe FeSO4 + Cu
上述两种方法中,你认为哪种方法更好 _____,原因是 _____(写出1条原因即可)。分别用火法炼铜与湿法炼铜生产640gCu,则转移的电子数之比为 ______。
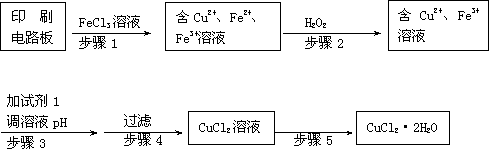
Ⅱ、印刷电路板上使用的铜需要回收利用。
用FeCl3溶液浸泡印刷电路板制备CuCl2·2H2O晶体,实验室模拟回收过程如下:
①步骤2中反应的离子方程式是________ 。
②步骤5中蒸发浓缩CuCl2溶液时,要滴加浓盐酸,目的是________________ (用化学方程式并结合简要的文字说明),再经冷却、结晶、过滤,得到CuCl2·2H2O晶体。
③步骤4中洗涤沉淀的操作为_______
④步骤3中可选用的“试剂1”是________ (写出一种即可),目的是使溶液的pH升高到4,此时Fe3+浓度为 ________ [Ksp(Fe(OH)3)=4×10-38]。
正确答案
Ⅰ
湿法炼铜(或方法二) 不会产生污染空气的气体(或湿法炼铜不需要外界提供能量) 3:2
Ⅱ
① 2Fe2++ H2O2 + 2 H+ = 2Fe3+ + 2H2O
②CuCl2在溶液中可以发生水解反应: CuCl2+2H2O 
③ 向漏斗中加少量蒸馏水(水)至没过沉淀,静置滤干后重复操作2~3次。
④ CuO[或Cu(OH)2] 4×10-8mol/L
解析
解析已在路上飞奔,马上就到!
知识点
9.据悉,奥运会上使用的发令枪所用的“火药”成分是氯酸钾和红磷,经撞击发出响声,同时产生白色烟雾。撞击时发生的化学反应方程式为:5KClO3+6P=3P2O5+5KCl,则下列有关叙述错误的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
11.把图二中的碎纸片补充到图一中,可得到一个完整的离子方程式。对该离子方程式说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
8.有一混合溶液,其中只含有Fe2+、Cl—、Br—、I—(忽略水的电离)其中Cl—、Br—、I—的个数比为2:3:4,向该溶液中通入氯气使溶液中Cl—和Br—的个数比为3:1,则通入氯气的物质的量与溶液中剩余Fe2+的物质的量之比为(还原性I—> Fe2+> Br—> Cl—)( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
12.已知硫化亚铜与一定浓度的硝酸共热,所得溶液中只有硝酸铜和硫酸铜,放出一氧化氮和二氧化氮两种气体,且两种气体的物质的量之比为3:7,则参加反应的硫化亚铜和作氧化剂的硝酸的物质的量之比为( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
13.把物质的量均为0.1mol的AlCl3、CuCl2和H2SO4溶于水制成100ml的混合溶液,用石墨做电极电解,并收集两电极所产生的气体,一段时间后在两极收集到气体在相同条件下体积相同。则下列描述正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
4.在3S + 6KOH = 2K2S + K2SO3 + 3H2O反应中,作氧化剂的S原子与作还原剂的S原子的物质的量之比是 ( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
19.
已知:铅蓄电池总的化学方程式为:Pb+PbO2+2H2SO4 
镍镉碱性充电电池在放电时,其
正极反应为:2NiO(OH)+2H2O+2e-=2Ni(OH)2+2OH-
负极反应为:Cd+2OH--2e-=Cd(OH)2
铅蓄电池使用(放电)一段时间后,其内阻明显增大,电压却几乎不变,此时只有充电才能继续使用。镍镉碱性充电电池使用(放电)到后期,当电压明显下降时,其内阻却几乎不变,此时充电后也能继续使用。回答下列问题:
⑴铅蓄电池在放电时的负极反应为( ),其在充电时阳极反应为( );
⑵镍镉碱性充电电池在充电时的总反应的化学方程式为( );
⑶上述两种电池使用一段时间后,一个内阻明显增大,而另一个内阻却几乎不变的
主要原因可能是 ( );
⑷如果铅蓄电池在放电时回路中有2mol电子转移时,消耗H2SO4( )mol。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
13. 水热法制备Fe3O4纳米颗粒的反应为3Fe2+ +2S2O32-+O2 +xOH-=Fe3O4+S4O62-+2H2O,下列说法中不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
9. 下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析