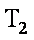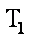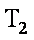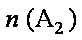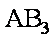- 化学反应原理
- 共2396题
温度为T时,向2.0L恒容密闭容器中充入1.0 molPCl5,反应PCl5(g)
下列说法正确的是
正确答案
解析
本题素材似乎来源于《选修四》课本第32页习题的第8题,属于基本理论中化学平衡问题,主要考查学生对速率概念理解与计算,平衡常数概念与计算,平衡移动等有关内容理解和掌握程度。高三复习要让学生深刻理解一些基本概念的内涵和外延。A反应在前50 s内的平均速率应该是前50 s内PCl3浓度变化与时间的比值,而不是PCl3物质的量的变化与时间的比值。B相同温度下,起始时向容器中充入1.0molPCl5、0.20molPCl3和0.20molCl2应先求平衡常数K为0.025,再求浓度商(Qc)为0.02,K>Qc,说明平衡向正反应方向移动。C保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,平衡向右移动,达到新平衡时CO转化率增大,H2O转化率减小,H2O的体积分数会增大。D从等效平衡的角度,先建立原容器两倍关系的模型,即与原平衡完全等效,再把容器两倍关系压缩成原容器,则平衡向逆反应方向移动,PCl3的转化率应大于80%
知识点
(18分)请运用化学反应原理的相关知识研究元素及其化合物的性质。
(1)工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
正确答案
解析
略。
知识点
大气中的部分碘源于O3对海水中Ⅰ-的氧化。将O3持续通入NaⅠ溶液中进行模拟研究。
(1)O3将Ⅰ-氧化成Ⅰ2的过程由3步反应组成:
①Ⅰ-(aq)+ O3(g)=ⅠO-(aq)+O2(g)△H1
②ⅠO-(aq)+H+(aq) 
总反应的化学方程式为______,其反应△H=______
(2)在溶液中存在化学平衡:
(3) 为探究Fe2+对氧化Ⅰ-反应的影响(反应体如图13),某研究小组测定两组实验中Ⅰ3-浓度和体系pH,结果见图14和下表。
1 Ⅰ组实验中,导致反应后pH升高的原因是_______.
2 图13中的A为_____由Fe3+生成A的过程能显著提高Ⅰ-的转化率,原因是_______.
3 第2组实验进行18s后,Ⅰ3-下降。导致下降的直接原因有双选______.
a. c(H+)减小 b. c(Ⅰ-)减小 c. Ⅰ2(g)不断生成 d. c(Fe3+)增加
(4)据图14,计算3-13s内第2组实验中生成l3-的平均反应速率(写出计算过程,结果保留两位有效数字)。
正确答案
见解析
解析
⑴三者相加:2I-(aq)+ O3(g)+2H+(aq)
△H=△H1+△H2+△H3
⑵
⑶①由2I-(aq)+ O3(g)+2H+(aq)
⑷直接根据速率公式可求:5.5x10-4mol/(L.S)
知识点
O3也是一种很好的消毒剂,具有高效、洁净、方便、经济等优点。O3可溶于水,在水中易分解,产生的[O]为游离氧原子,有很强的杀菌消毒能力。常温常压下发生反应如下:
反应① O3
反应② [O]+O3
总反应:2O3
(1)一定条件下,O3的浓度减少一半所需的时间(t)如下表所示。
已知:O3的起始浓度为0.0216 mol/L。
在30°C、pH=4.0条件下,O3的分解速率为_______________ mol/ (L·min)。
(2)根据表中数据,推测O3在下列条件下分解速率由小到大的顺序为________。(填字母代号)
A,40°C、pH=3.0
B,10°C、pH=4.0
C,30°C、pH=7.0
(3)下列叙述正确的是
A,降低温度,K增大
B,K=K1+K2
C,适当升温,可提高消毒效率
D,压强增大,K2减小
正确答案
(1)1×10-4
(2)B<A<C
(3)AC
解析
略
知识点
一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g) 
正确答案
解析
略。
知识点
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g) 
正确答案
解析
本题属于基本理论中化学平衡问题,主要考查学生对速率概念与计算,平衡常数概念与计算,平衡移动等有关内容理解和掌握程度。高三复习要让学生深刻理解一些基本概念的内涵和外延。A:反应在t1min内的平均速率应该是t1min内H2浓度变化与t1的比值,而不是H2物质的量的变化与t1的比值。B:因为反应前后物质的量保持不变,保持其他条件不变,平衡常数不会改变,起始时向容器中充入议0.60molCO和1.20 molH2O,似乎与起始时向容器中充入0.60molH2O和1.20 molCO效果是一致的,到达平衡时,n(CO2)=0.40 mol。C:保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,平衡向右移动,达到新平衡时CO转化率增大,H2O转化率减小,H2O的体积分数会增大。D:原平衡常数可通过三段式列式计算(注意浓度代入)结果为1,温度升至800℃,上述反应平衡常数为0.64,说明温度升高,平衡是向左移动的,那么正反应应为放热反应。
知识点
自然界的矿物、岩石的成因和变化受到许多条件的影响。地壳内每加深1km,压强增大约25000~30000 kPa。在地壳内SiO2和HF存在以下平衡:SiO2(s) +4HF(g)
根据题意完成下列填空:
(1)在地壳深处容易有________气体逸出,在地壳浅处容易有________沉积。
(2)如果上述反应的平衡常数K值变大,该反应________(选填编号)。
a. 一定向正反应方向移动
b. 在平衡移动时正反应速率先增大后减小
c. 一定向逆反应方向移动
d. 在平衡移动时逆反应速率先减小后增大
(3)如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时,________(选填编号)。
a. 2v正(HF)=v逆(H2O)
b. v(H2O)=2v(SiF4)
c. SiO2的质量保持不变
d. 反应物不再转化为生成物
(4)若反应的容器容积为2.0L,反应时间8.0 min,容器内气体的密度增大了0.12 g/L,在这段时间内HF的平均反应速率为________。
正确答案
(1)SiF4 、H2O;SiO2
(2)ad
(3)bc
(4)0.0010mol(L·min)
解析
本题考察外界条件对化学平衡的影响、化学平衡常数和化学平衡状态的的理解以及反应速率的有关计算。
(1)地壳深处温度低,使得平衡右移,会逸出SiF4、水蒸气气体;浅处温度高平衡左移动,析出SiO2沉淀。
(2)由于反应吸热,平衡常数K值变大,说明温度降低,则平衡正向移动,温度降低后逆反应速率开始要减小,由于平衡右移动,故逆反应速率又会逐渐增大直至到达新的平衡。
(3)平衡时a项v正(HF)= 2v逆(H2O),d项反应继续进行只是转化的生成物与分解的生成物相等。
(4)密度增大了0.12 g/L,说明质量增加了0.24g,即参加反应的SiO2为0.24g,其物质的量为0.004mol,则转化的HF为0.016mol,则HF的反应速率为
知识点
研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)利用反应:6NO2+8NH3
若在120℃时该反应在一容积为2L的容器内反应,20min时达到平衡,10min时电子转移了1.2mol,则0~10min时,平均反应速率υ(NO2)= 。
(2)一定条件下NO2与SO2可发生反应,其方程式为:
NO2(g)+SO2(g)
A、体系压强保持不变
B、混合气体颜色保持不变
C、SO3和NO的体积比保持不变
D、混合气体的平均相对分子质量保持不变
(3)若改变条件,使平衡常数变大,该反应 。
A、一定向正反应方向移动
B、在平衡移动时,正反应速率先减小后增大
C、一定向逆反应方向移动
D、在平衡移动时,逆反应速率先增大后减小
(4)CO可用于合成甲醇,反应方程式为CO(g) + 2H2(g)
CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应 (填“放热”或“吸热”)。实际生产条件控制在250℃、1.3×104 kPa左右,选择此压强的理由是: 。
正确答案
(1)0.015mol/L.min ;
(2)B
(3)A
(4)放热 在此压强下,CO转化率已很高,压强太高,会增加设备的成本。
解析
略
知识点
某温度下,向2 L恒容密闭容器中充入1.0 mol A和1.0 mol B,反应
正确答案
解析
略
知识点
硫的化合物在生产和科研中发挥着重要作用。
(1)SO2Cl2常用于制造医药品、染料、表面活性剂等。已知:
SO2Cl2(g)
某温度时向体积为1 L的恒容密闭容器中充入0. 20mol SO2Cl2,达到平衡时,容器中含0.18mol SO2,则此过程反应吸收的热量为________kJ,该温度时反应的平衡常数为________。将上述所得混合气体溶于足量BaCl2溶液中,最终生成沉淀的质量为________。
(2)工业上制备硫酸的过程中存在反应:
2SO2(g)+O2(g) 
400℃,1.01×105Pa,向容积为2L的恒容密闭容器中充入一定量 SO2和O2,n(SO3)和n(O2)随时间的变化曲线如图所示。
①0~20min反应的平均速率υ(O2)=________。
②下列叙述正确的是________。
a. A点υ正(SO2) >υ逆(SO2)
b. B点处于平衡状态
c. C点和D点n(SO2)相同
d. 其它条件不变,500℃时反应达平衡,n(SO3)比图中D点的值大
(3)工业上用Na2SO3溶液吸收烟气中的SO2。将烟气通入1.0 mol·L-1的Na2SO3溶液,当溶液pH约为6时,Na2SO3溶液吸收SO2的能力显著下降,应更换吸收剂。此时溶液中c (SO32-)的浓度是0.2 mol·L-1,则溶液中c(HSO3-)是________mol·L-1。
正确答案
(1)17.5;1.62;46.6g
(2)0.02mol/(L·min);ac;1.6mol·L-1
解析
略。
知识点
在100℃时,将N2O4、NO2分别充入两个各为1 L的密闭容器中,反应过程中浓度变化如下:[2NO2(g) 
下列说法正确的是
正确答案
解析
略
知识点
研究NO2、NO、SO2 、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为 _____________ 。
利用反应6NO2(g)+ 8NH3(g)
则化学平衡常数表达式K= _____________- ;
当转移1.2mol电子时,消耗的NO2在标准状况下是 _____________ L。
(2) 汽车尾气中含有NO和CO气体,对环境有影响。已知平衡常数K的值大小,是衡量化学反应进行程度的标志。在25℃时,下列反应及平衡常数如下
2NO(g) 
2CO(g)+O2(g) 
为了完成汽车尾气处理装置的改造,除去氮氧化物、一氧化碳污染气体,根据上述有关数据判断,下列说法正确的是
A. 改造后的尾气装置使用高温高压,可大量减少污染气体的排放
B. 汽车尾气中氮氧化物在空气中会自动的转化为氮肥,对植物生长有益,可不必除去
C. 改造后的尾气装置使用催化剂,可大量减少污染气体的排放
D. 根据K1和 K2的数据,尾气中NO和CO可自行转化为无害气体
(3) 一定条件下将CO和H2O发生反应,可减少CO对环境的影响。若在700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g) 
反应过程中测定的部分数据见下表(表中t1>t2):
反应在t1min内的平均速率为v(H2)= ________mol·L-1·min-1
保持其他条件不变,起始时向容器中充入2.40molCO和1.20 molH2O,到达平衡时,
n(CO2) _______0.80 mol(填:大于、小于、等于)。
(4)酸雨是大气污染的危害之一,二氧化硫(SO2)的含量是空气质量监测的一个重要指标。某兴趣小组同学收集某地的雨水进行实验,每隔1h,通过pH计测定雨水样品的pH,测得的结果如下表:
请写出上述PH变化的原因(用化学方程式表示)_______________________________.
正确答案
(1)3NO2+H2O →2HNO3+NO ; K=[N2]7[H2O]12/[NO2]6[NH3]8 ;6.72
(2)c
(3)0.2/t1 ;等于
(4)2H2SO3 +O2 → 2H2SO4
解析
略
知识点
用氮化硅陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅,其反应如下:
(1) SiCl4的平均反应速率为___
(2)平衡后,若改变温度,混合气体的平均相对分子质量与温度的
关系如图所示,下列说法正确的是
A.该反应在任何温度下可自发进行
B,若混合气体的总质量不变,表明上述反应己达到平衡状态
C、其他条件不变,增大Si3N4的物质的量,平衡向左移动
D.按3:2:6的物质的量比增加反应物,SiC14(g)的转化率降低
(3)下表为不同温度下该反应的平衡常数,其他条件相同时,在___(填"T1”、“T2”.,
“T3”)温度下反应达到平衡所需时间最长:
假设温度为T1时向该反应容器中同时加入。(SiC14) =0.3 mol/L,c(H2) =0.3 mol/L,,c(N2) =
x mol/L, c (HCD =0.3 mol/L和足量Si3N4 (s),若要使平衡建立的过程中HCl浓度减小,x的取值
范围为___
(4)该反应的原子利用率为____
(5)工业上制备SiCl4的反应过程如下:
写出二氧化硅、焦炭与Cl 2在高温下反应生成气态SiC14和一氧化碳的热化学方程式_____
正确答案
(1)
(2)AB(2分)
(3)
(4))24.22%(2分)
(5)
解析
略
知识点
氢气被誉为21世纪的新型清洁能源,能有效降低二氧化碳的排放。以甲醇为原料经过重整可以获得氢气。其工业流程如下:
请回答以下问题:
(1)液态甲醇雾化后与水蒸气混合,其目的是______;该工业流程中可以循环利用的物质是______(填名称)。
(2)为了测定CH3OH(g) + H2O(g) → CO2(g) + 3H2(g)的反应速率,在某温度下用气体传感器测得不同时间的甲醇和水蒸气浓度如下:
(i)前2s内的平均反应速率v(H2)=___________
(ii)在该温度下,反应的平衡常数表达式K=_________
(3)为了研究反应条件对CO含量的影响,在甲醇含量为50%,原料液进料量60mL/h的情况下,在常压下和在不同催化环境下得到了反应温度与CO含量的关系图。从图中得到的有关结论是_______________________(写出其中一个即可)
(4)为研究反应中压强对CO含量的影响,请简述你的实验方案:__________________;
正确答案
(1)让反应物充分接触,加快反应速率。 一氧化碳
(2) 1.125X10-3 mol/(LS)
K= ([H2]3[CO2] )/([CH3OH][H2O])
(3)最佳反应温度230℃
(4)在甲醇含量为50%,原料液进料量60mL/h ,温度一定情况下,测定不同压强下CO 含量
解析
略
知识点
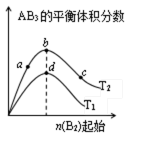
12. 某化学小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+3B2(g) 2AB3(g)化学平衡状态的影响,得到如下图所示的曲线(图中T表示温度,n表示物质的量)下列判断正确的是( )
正确答案
解析
略
知识点
扫码查看完整答案与解析