- 化学反应原理
- 共2396题
高炉炼铁过程中发生的反应:

正确答案
解析
略
知识点
(18分)请运用化学反应原理的相关知识研究元素及其化合物的性质。
(1)工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
正确答案
解析
略。
知识点
6.恒温恒容下向2 L密闭容器中加入SO3发生反应:2SO3(g) 
应过程中测定的部分数据如下表:
下列说法正确的是( )
正确答案
解析
2SO3(g) 
开始(mol/l) 1.0 0 0
0-2min变(mol/l) 0.6 0.6 0.3
2min末(mol/l) 0.4 0.6 0.3
4min末(mol/l) 0.4 0.6 0.3
4-6min变(mol/l) 0.5 0.5 0.25
6min末(mol/l) 0.9 0.1 0.5
A.0~2 min平均速率v(SO2) = 0.3 mol·L-1·min-1故A错
B.该反应正方向气体分子数目增大,减小压强,平衡正移,而数据显示逆移,说明不是减压。故B错。
C.2min已经达到平衡状态,算出K=0.3,升高温度,K增大,说明反应吸热,C正确。
D.反应物量减小一半,若平衡不移动,则生成物也为原平衡的一半,但反应物减小,压强减小,平衡正移,n(SO2)>0.6 mol
考查方向
本题考查了化学平衡移动,化学平衡状态的特征以及化学反应速率等知识点。
解题思路
见解析
教师点评
本题考查了化学平衡和反应速率的知识点,涉及知识点多,综合性较强,在高考中出现频率高,但一般在大题。
知识点
高炉炼铁过程中发生的主要反应为
已知该反应在不同温度下的平衡常数如下:
请回答下列问题:
(1)该反应的平衡常数表达式K=_____________,△H________0(填“>”、“<”或“=”);
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过l0 min后达到平衡。求该时间范围内反应的平均反应速率
(3)欲提高(2)中CO的平衡转化率,可采取的措施是_____________。
a.减少Fe的量
b.增加Fe203的量
c.移出部分C02
d.提高反应温度
e.减小容器的容积
f.加入合适的催化剂
正确答案
(1)K=
(2)0.006 mol·L-1·min-1;60%
(3)c
解析
本题主要考察化学反应速率的概念及计算、外界条件对化学平衡的影响、化学平衡常数的概念及计算以及反应热的有关判断。(1)平衡常数是指在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积当比值,但需要注意但是固体和纯液体的浓度视为常数,不能出现在表达式中;从表中数据可知随着温度的升高平衡常数逐渐减小,这说明温度升高平衡向逆反应方向移动,所以正反应是放热反应,即△H<0。(2)
在1000℃时K=4.0,所以有
因此C02的浓度变化量为:c(C02)=




CO的转化率为
(3)因为该反应是一个放热且体积不变的可逆反应,所以要提高CO的平衡转化率,可以采取降低温度或降低生成物浓度来实现,而固体和催化剂不能改变平衡状态,所以选项c正确。
知识点
化学反应原理在科研和生产中有广泛应用
(1)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应
TaS2(s)+2I2(g)
反应(I)的平衡常数表达式K= ,若K=1,向某恒容密闭容器中加入1mol I2(g)和足量TaS2(s),I2(g)的平衡转化率为
(2)如图所示,反应(I)在石英真空管中进行,先在温度为T2的一端放入未提纯的TaS2粉末和少量I2(g),一段时间后,在温度为T1的一端得到了纯净的TaS2晶体,则温度T1 T2(填“﹥”“﹤”或“=”)。上述反应体系中循环使用的物质是 。
(3)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢铁中的硫转化为H2SO3,然后用一定浓度的I2溶液进行滴定,所用指示剂为 ,滴定反应的离子方程式为
(4)25℃时,H2SO3 
mol/L,若向NaHSO3溶液中加入少量的I2,则溶液中将 (填“增大”“减小”或“不变”)。
正确答案
(1)
(2)<,I2
(3)淀粉溶液,H2SO3+I2+H2O=4H++SO42-+2I-
(4)1.0×10-12,增大
解析
(1)
(2)由所给方程式可知该反应为吸热反应,通过题意温度T2端利于反应正向进行,为高温,温度T1端利于反应向左进行,为低温,所以T1<T2。I2是可以循环使用的物质。
(3)因为I2遇到淀粉会变蓝色,所以可以用淀粉溶液作指示剂.离子反应:H2SO3+I2+H2O=4H++SO42-+2I-.
(4)Ka=


知识点
研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)
2NO(g)+Cl2(g)
(1)4NO2(g)+2NaCl(s)
(2)为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(II)达到平衡。测得10min内v(ClNO)=7.5×10-3mol•L-1•min-1,则平衡后n(Cl2)=_______mol,NO的转化
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol•L‾1的CH3COONa溶液,则两溶液中c(NO3-).c(NO2-)和c(CH3COO-)由大到小的顺序为_______。(已知HNO2的电离常数Ka=7.1×10-4mol•L-1,CH3COOH的电离常数K a=1.7×10-5mol•L-1,可使溶液A和溶液B的pH相等的方法是_______。
a. 向溶液A中加适量水
b. 向溶液A中加适量NaOH
c. 向溶液B中加适量水
d. 向溶液B中加适量NaOH
正确答案
(1)
(2)2.5x10-2; 75%;>;不变;升高温度
(3)c(NO3-)>c(NO2-)>c(CH3COO-);b.c
解析
略。
知识点
大气中的部分碘源于O3对海水中Ⅰ-的氧化。将O3持续通入NaⅠ溶液中进行模拟研究。
(1)O3将Ⅰ-氧化成Ⅰ2的过程由3步反应组成:
①Ⅰ-(aq)+ O3(g)=ⅠO-(aq)+O2(g)△H1
②ⅠO-(aq)+H+(aq) 
总反应的化学方程式为______,其反应△H=______
(2)在溶液中存在化学平衡:
(3) 为探究Fe2+对氧化Ⅰ-反应的影响(反应体如图13),某研究小组测定两组实验中Ⅰ3-浓度和体系pH,结果见图14和下表。
① Ⅰ组实验中,导致反应后pH升高的原因是_______.
② 图13中的A为_____由Fe3+生成A的过程能显著提高Ⅰ-的转化率,原因是_______.
③第2组实验进行18s后,Ⅰ3-下降。导致下降的直接原因有双选______.
(4)据图14,计算3-13s内第2组实验中生成l3-的平均反应速率(写出计算过程,结果保留两位有效数字)。
正确答案
(1)
(2)
(3)①H+被消耗,其浓度降低;②


(4)
解析
本题考查了盖斯定律、化学平衡常数,化学平衡的移动以及化学反应速率的计算等知识。(1)根据题给信息,总反应为O3氧化I-生成I2,将所给的三个反应:①+②+③可得



③c(Fe3+)增加,
v(I3-)=
知识点
海水资源的利用具有广阔前景。海水中主要离子的含量如下:
(1)电渗析法淡化海水示意图如右图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过。
①阳极主要电极反应式是 。
②在阴极附近产生少量白色沉淀,其成分有 和CaCO3,
生成CaCO3的离子方程式是 。
③淡水的出口为 (填“a”、“b”或“c”)。
(2)利用海水可以提取溴和镁,提取过程如下:
①提取溴的过程中,经过2次Br-→Br2转化的目的是 ,吸收塔中发生反应的离子方程式是 。解释通空气的目的是 。
②从MgCl2溶液中得到MgCl2·6H2O晶体的主要操作是 、过滤、洗涤、干燥。
③依据上述流程,若将10 m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为 L(忽略Cl2溶解,溴的相对原子质量:80)。
正确答案
(1)①(2分)2Cl—-2e—=Cl2↑
②(2分)Mg(OH)2 (2分)Ca2++ OH—+HCO3—=CaCO3↓+H2O
③(2分)b
(2)①(1分)对溴元素进行富集 (2分)SO2+Br2+2H2O=4H++2Br—+SO42—
(2分)通入空气将Br2蒸气带出
②(1分)加热浓缩、冷却结晶
③(2分)179.2
解析
略
知识点
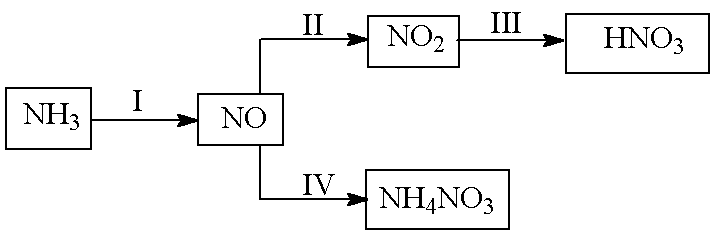
NH3经一系列反应可以得到HNO3和NH4NO3,如下图所示。
(1)I中,NH3和O2在催化剂作用下反应,其化学方程式是________________________。
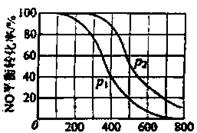
(2)II中,2NO(g) +O2(g) 
①比较p1.p2的大小关系_____________。
②随温度升高,该反应平衡常数变化的趋势是_______________。
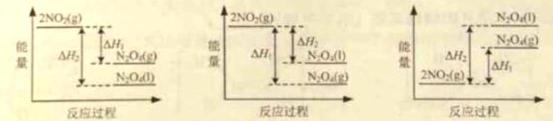
(3)III中,将NO2(g)转化成N2O4(l),再制备浓硝酸。
①已知:2NO2(g) 
2NO2(g) 
②N2O4与O2.H2O化合的化学方程式_________________________________________。
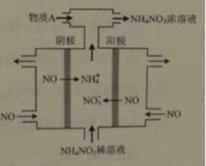
(4)IV中,电解NO制备NH4NO3,其工作原理如右图所示,为使电解产物全部转化为NH4NO3,需补充物质A,A是________,说明理由:_____________________________________________________________。
正确答案
答案:(1)4NH3+5O2 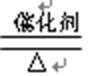
(2)①p2> p1 ②变小
(3)①A ②2N2O4+O2+2H2O=4HNO3
(4)NH3 根据电子守恒,阳极得到的NO3—的量大于阴极得到的NH4+的量,所以需充入NH3(或从阴阳极电极反应式说明也可)
解析
略
知识点
28.乙苯催化脱氢制苯乙烯反应:
(1)已知:
计算上述反应的△H=_______
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生催化脱氢反应。已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数K=____________ (用α等符号表示)。
(3)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1︰9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如下:
①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实___
②控制反应温度为600℃的理由是____________。
(4)某研究机构用CO2代替水蒸气开发了绿色化学合成工艺——乙苯-二氧化碳耦合催化脱氢制苯乙烯。保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;该工艺中还能够发生反应:CO2+H2=CO+H2O,CO2+C=2CO。新工艺的特点有_________(填编号)。
① CO2与H
② 不用高温水蒸气,可降低能量消耗
③ 有利于减少积炭
④ 有利于CO2资源利用
正确答案
(1)124 ; (2) 

(3) ① 正反应方向气体分子数增加,加入水蒸气起稀释,相当于起减压的效果
②600℃时,乙苯的转化率和苯乙烯的选择性均较高。温度过低,反应速率慢,转化率低;温度过高,选择性下降。高温还可能使催化剂失活,且能耗大
(4) ①②③④
性下降。高温还可能使催化剂失活,且能耗大。(4) ①乙苯催化脱氢制苯乙烯反应为可逆反应,CO2与H2
反应,可使生成物浓度减小,化学平衡右移;②不用高温水蒸气,必然降低能耗;③由于发生反应
CO2+C=2CO,可减少积炭;④CO2得到有效利用,可减少CO2排放并作为资源得到利用。故选择①②③④。
解析
解析已在路上飞奔,马上就到!
知识点
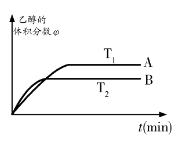
据报道,在一定条件下,由CO2和H2合成乙醇已成为现实,该合成对解决能源问题具有重大意义。
(1)CO2和H2合成乙醇的化学方程式为:
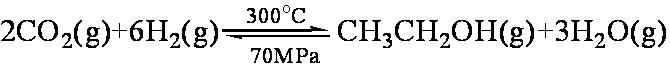
如果只是压强增大,则该反应的化学平衡常数K将 (填:“增大”、“减小”或“不变”);
②从上图可知,该平衡正向的ΔH 0(填“>”、“<”或“=”)。
(2)对于该化学平衡,为了提高H2的转化率,可采取的措施有 。
A.加压
B.升温
C.加催化剂
D.增加CO2的浓度
(3)已知25oC、101 kPa条件下,1 g乙醇燃烧生成CO2和液态水时释放出a kJ热量,请写出该条件下乙醇燃烧热的热化学反应方程式: 。
(4)现有甲装置为原电池(a电极通氧气,b电极通乙醇),乙装置为电解池:
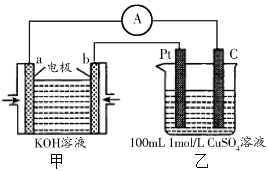
② 若甲中有0.01mol CH3CH2OH参加反应,则乙装置中生成的气体在标准状况下的体积共为 L 。
正确答案
见解析。
解析
(1)① 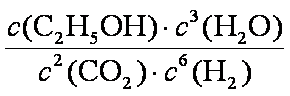
(2)A、D ;
(3)C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH=-46a kJ/mol ;
(4)①C2H5OH-12e-+16OH-=2CO
②0.672 。
知识点
请运用化学反应原理的相关知识研究元素及其化合物的性质。
(1)工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO(g)+2H2(g)═CH3OH(g)△H1=﹣116KJ•mol﹣1
又知:CO(g)+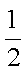
H2(g)+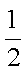
H2(g)+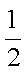
则甲醇的燃烧热为_______。
(2)T℃时,向2L密闭容器中充入4mol CO和6mol H2,5min后达平衡时CH3OH物质的量为2mol,该反应的速率v(H2)为_______;下列措施中有利于增大该反应的反应速率且提高转化率的是_______。
A. 随时将CH3OH与反应混合物分离
B. 降低反应温度
C. 使用高效催化剂
D. 增大体系压强
(3)在密闭容器中充有10mol CO与20mol H2,在催化剂作用下反应生成甲醇,CO的转化率(a)与温度(T)、压强(P)的关系如图所示。
①A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间,tA_______tc(填“大于”、“小于’’或“等于“)。
②若A点时容器的体积为10L,该温度下B点的平衡常数K=_______。
(4)Na2SO3的水溶液呈_______(填“酸”、“中”、‘‘碱”)性,原因是(用离子方程式表示):_______;把CaCO3浊液滴入l.0mol/L的Na2SO3溶液中,能否产生CaSO3沉淀?若不能,说明原因;若可行,请简述判断依据及转化过程_______(已知:Ksp(CaSO3)=1.4×10﹣7,Ksp(CaCO3)=2.8×10﹣9)。
正确答案
(1)﹣739kJ•mol﹣1
(2)0.4mol/(L•min)d
(3)①大于 ②1
(4)碱 SO32﹣+H2O⇌HSO3﹣+OH﹣ 可行,判断依据是:由Ksp(CaSO3)/Ksp(CaCO3)=50知,当CaSO3与CaCO3的混合液中c(SO32﹣)>50c(CO32﹣)时,即发生由CaCO3向CaSO3的转变;转化过程为:把CaCO3浊液滴入0。1mol/L的Na2SO3溶液中时,溶液中的c(Ca2+)与c(SO32﹣)之积大于Ksp(CaSO3),生成CaSO3沉淀,导致溶液中c(Ca2+)减小,使CaCO3的沉淀溶解平衡CaCO3⇌Ca2++CO32﹣,向着溶解的方向移动,导致CaCO3溶解。
解析
略。
知识点
降低太气中

(1)将燃煤废气中的

①某温度下,将2。0mol
则











②一定条件下,上述反应在密闭容器中达平衡。当仅改变影响反应的一个条件,引起的下列变化能说明平衡一定向正反应方向移动的是________。
a. 反应物的浓度降低
b. 容器内压强增大
c. 正反应速率大于逆反应速率
d. 化学平衡常数K增大
(2)碳酸氢钾溶液加水稀释,

a.
b.
c. 降低温度,
正确答案
(1) ①>;<;57.14%;② cd
(2)增大;b
(3)2Fe3+ +3CO32-+3H2O=2Fe(OH)3(胶体)+3CO2↑
解析
略。
知识点
大气中的部分碘源于O3对海水中I-的氧化。将O3持续通入NaI溶液中进行模拟研究。
(1)O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+ O3(g)= IO-(aq)+O2(g)△H1
②IO-(aq)+H+(aq) 
③HOI(aq) + I-(aq) + H+(aq) 
总反应的化学方程式为________,其反应△H=________。
(2)在溶液中存在化学平衡:I2(aq) + I-(aq) 
(3) 为探究Fe2+ 对O3氧化I-反应的影响(反应体如图13),某研究小组测定两组实验中I3-浓度和体系pH,结果见图14和下表。
①第1组实验中,导致反应后pH升高的原因是________。
②图13中的A为__ ___,由Fe3+生成A的过程能显著提高Ⅰ-的转化率,原因是________。
③第2组实验进行18s后,I3-浓度下降。导致下降的直接原因有(双选)________。
A. c(H+)减小
B. c(I-)减小
C. I2(g)不断生成
D. c(Fe3+)增加
(4)据图14,计算3-18s内第2组实验中生成I3-的平均反应速率(写出计算过程,结果保留两位有效数字)。
正确答案
(1) O3+2Ⅰ—+2H+=Ⅰ2+ O2+ H2O,△H=△H1+△H2+△H3。
(2)
(3)反应过程中消耗氢离子,溶液酸性减弱,pH增大,水电离出氢离子参与反应破坏水的电离平衡,氢氧根浓度增大,溶液呈碱性,pH增大;Fe3+,该过程是非氧化还原;BD
(4)(计算过程略)5.5×10—4 mol/L·s
解析
略。
知识点
火力发电厂释放出大量气体会造成环境污染。对燃煤废气进行处理,可实现绿色环保、废物利用等目的。
(1)CO可以与H2O(g)发生反应:CO(g) + H2O(g) 
在甲、乙、丙三个恒容密闭容器中,起始时按照下表进行投料,在800℃时达到平衡状态,K=1.0。
①该反应的平衡常数表达式为 。
②平衡时,丙容器中H2O的物质的量是 mol,甲容器中CO的转化率是 ,
容器中CO的转化率:乙 甲(填“>”、“=”或“<”)。
③丙容器中,其他条件不变时,温度 (填“升高”或“降低”),CO的平衡转化率升高。
(2)除去氮氧化物:
① 利用甲烷催化还原NOx:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160 kJ·mol-1
甲烷直接将NO2还原为N2的热化学方程式为__________
② 也可用氨气与之发生反应:NOx+NH3→N2+H2O。
现有NO2和NO的混合气体3.0 L,跟3.4 L(同温同压下)NH3反应,恰好使其全部转化为氮气,则原混合气体中,NO2与NO的体积比是__________。
正确答案
见解析。
解析
(1)①
②0.1 50% >
③ 降低
(2)①CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol (3分)
② 7 : 3
知识点
扫码查看完整答案与解析