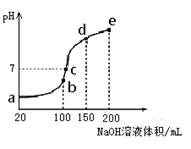- 化学反应原理
- 共2396题
用氮化硅(Si3N4)陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅,其反应如下:
3SiCl4(g)+2N2(g)+6H2(g)
完成下列填空:
(1)在一定温度下进行上述反应,若反应容器的容积为2 L,3 min后达到平衡,测得固体的质量增加了2.80 g,则H2的平均反应速率___ mol/(L·min);该反应的平衡常数表达式K=_____
(2)上述反应达到平衡后,下列说法正确的是_。
a.其他条件不变,压强增大,平衡常数K减小
b.其他条件不变,温度升高,平衡常数K减小
c.其他条件不变,增大Si3N4物质的量平衡向左移动
d.其他条件不变,增大HCl物质的量平衡向左移动
(3)一定条件下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是__。
a.3v逆(N2)=v正(H2)
b.v正(HCl)=4v正(SiCl4)
c.混合气体密度保持不变
d.c(N2):c(H2):c(HCl)=1:3:6
(4)若平衡时H2和HCl的物质的量之比为

正确答案
(1) 0.02 、 
(2)bd
(3)ac ;
(4)<
解析
本题考查化学反应速率与化学平衡,意在考查考生的思维能力和分析、推断能力。
(1)由方程式可知固体(Si3N4)质量增加2.80g时消耗n(H2)=2.80g/140g·mol-1×6=0.12mol,故v(H2)=0.12mol/(2L·3min)=0.02mol/(L·min);利用反应方程式可直接写出反应的平衡常数表达式。
(2)因反应为放热反应,故反应达到平衡后,升高温度,平衡逆向移动,平衡常数K减小,b正确、温度不变,加压或改变反应物的浓度等平衡常数不变,a错误、其他条件不变,增加固体Si3N4平衡不移动,c错误、其他条件不变,增大HCl的物质的量,平衡向消耗HCl的逆反应方向移动,d正确。
(3)利用化学反应速率之比等于化学方程式计量系数比可知a项叙述表示v正=v逆,表示反应达到平衡态;b项均表示正反应,无论反应是否处于平衡态,都成立;d项表示的浓度关系与是否平衡无关;混合气体密度不变说明溶液中气体质量不变,而平衡移动则气体质量改变,所以c项表示达到平衡态。
(4)降低温度,平衡正向移动,n(H2)/n(HCl)变小。
知识点
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为:CrO42-


其中第①步存在平衡:2CrO42-(黄色)+2H+
(1)若平衡体系的pH=2,该溶液显_______色。
(2)能说明第①步反应达平衡状态的是_______。
a. 222Cr2O72-和222CrO42-的浓度相同
b.2v (Cr2O72-)=v (CrO42-)
c.溶液的颜色不变
(3)第②步中,还原1molCr2O72-离子,需要_______mol的FeSO4
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s) 
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH―)=10-32,要使c(Cr3+)降至10-5 mol/L,溶液的pH应调至_______。
方法2:电解法
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生222Cr(OH)3沉淀。
(5)用Fe做电极的原因为_______。
(6)在阴极附近溶液pH升高的原因是(用电极反应解释)_______,溶液中同时生成的沉淀还有_______。
正确答案
(1)橙
(2)c
(3)6
(4)5
(5)阳极反应为Fe-2e-=Fe2+,提供还原剂Fe2+
(6)2H++2e-=H2↑;Fe(OH)3
解析
(1) c (H+)增大,平衡2CrO42-(黄色)+2H+
(2)Cr2O72-和CrO42-的浓度相同时,并不能说明各组分的浓度不再改变了,故a不能说明反应已达平衡状态;v(Cr2O72-)和v(CrO42-)可表示正反应或逆反应,2v(Cr2O72-)=v (CrO42-)意义不明,不能说明正逆反应速率相等;溶液的颜色不再改变,也就是各物质的浓度不再改变,是平衡状态,故选c;
(3)还原1 molCr2O72-离子生成2 mol Cr3+,得到的电子数为6 mol,根据电子得失守恒可知,需要6 mol的FeSO4
(4)当c(Cr3+)=10-5 mol/L时,溶液的c(OH―)=
(5)在电解法除铬中,铁作阳极,铁优先失去电子生成Fe2+,以提供还原剂;
(6)在阴极附近溶液pH升高的原因是H+放电生成H2的同时,降低了溶液的酸性;Fe2+与Cr2O72-反应生成了Fe3+,Fe3+转化为Fe(OH)3沉淀。
知识点
甲醇是重要的化学工业基础原料和清洁液体燃料,它广泛用于有机合成、医药、农药、涂料、染料、汽车和国防等工业中。工业上一般在恒容密闭容器中采用下列反应合成甲醇:
CO(g)
下表所列数据是反应在不同温度下的化学平衡常数(K)。
(1)判断反应达到平衡状态的依据是
A,混合气体的密度不变
B,混合气体的平均相对分子质量不变
C,生成CH3OH的速率与消耗CO的速率相等
D。CH3OH、CO、H2的浓度都不再发生变化
(2)由表中数据判断Q 0 (填“>”、“
A,加入催化剂 B,充入CO C,充入H2 D,升温
(3)某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应10min后,达到平衡时测得c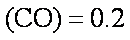
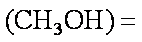
(3)原料CO和H2可以由C和H2O反应制取,涉及的反应方程式如下:
C(s)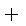

C(s)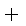

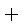
CO(g)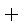

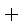
则K1、K2 、K3之间的关系是: 。
正确答案
(1) BD
(2)>、C
(3)0.08 80%
(4) K2=K1·K3
解析
略
知识点
固定和利用CO2,能有效地利用资源,并减少空气中的温室气体。工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是:
CO2 (g)



(1)若在恒温恒容的容器内进行该反应,则可用来判断该反应达到平衡状态的标志有 。
A,容器内的压强保持不变
B,容器中CH3OH浓度与CO2浓度相等
C,容器中混合气体的密度保持不变
D,CO2的生成速率与H2O的生成速率相等
某科学实验小组将6mol CO2和8mol H2充入一容积为2L的密闭容器中(温度保持不变),测得H2的物质的量随时间变化如下图中实线所示(图中字母后的数字表示对应的坐标)。回答下列问题:
(2)该反应在0~8min内CO2的平均反应速率是 mol·
(3)该反应的平衡常数表达式为 。
(4)仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示。与实线相比,曲线Ⅰ改变的条件可能是 ,曲线Ⅱ改变的条件可能是 。若实线对应条件下平衡常数为





正确答案
(1)AD
(2)0.125
(3) K= 
(4) 升温;加压;K=K2>K1
解析
略
知识点
一定条件下,在体积为10 L的密闭容器中,1 mol A和1 mol B进行反应:
2A(g)+B(g)
正确答案
解析
略
知识点
某恒温密闭容器中,可逆反应A(s)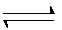
正确答案
解析
略
知识点
开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题。氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)已知:①2CH3OH(l)+ 3O2(g)= 2CO2(g)+ 4H2O(g)ΔH1 = –1275.6 kJ·mol– 1
②2CO(g)+ O2(g)= 2CO2(g) ΔH2 = –566.0 kJ·mol– 1
③H2O(g)= H2O(l) ΔH3 = –44.0 kJ·mol– 1写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:__________。
(2)生产甲醇的原料CO和H2来源于:CH4(g)+ H2O(g)
① 一定条件下CH4的平衡转化率与温度、压强的关系如图a。则,Pl P2;A、B、C三点处对应平衡常数(KA、KB、KC)的大小顺序为__________。(填“<”、“>”“=”)
② 100℃时,将1 mol CH4和2 mol H2O通入容积为100 L的反应室,反应达平衡的标志是:__________。
A. 容器内气体密度恒定
B. 单位时间内消耗0.1 mol CH4同时生成0.3 mol H2
C. 容器的压强恒定
D. 3v正(CH4)= v逆(H2)
如果达到平衡时CH4的转化率为0.5,则100℃时该反应的平衡常数K =__________。
(3)某实验小组利用CO(g)、O2(g)、KOH(aq)设计成如图b所示的电池装置,负极的电极反应式为__________。用该原电池做电源,常温下,用惰性电极电解200 mL饱和食盐水(足量),消耗的标准状况下的CO 224 mL,则溶液的pH =__________。(不考虑溶液体积的变化)
(4)氢氧燃料电池的三大优点是:__________、__________、能连续工作。
正确答案
(1)CH3OH(l)+ O2(g)= CO(g)+ 2H2O(l)ΔH = –442。8 kJ·mol– 1
(2)① <; KC> KB >KA;②CD 2.25×10– 4mol2·mol– 2
(3)CO + 4OH– → 
(4)污染少、能量利用率高
解析
略。
知识点
自然界的矿物、岩石的成因和变化受到许多条件的影响。地壳内每加深1km,压强增大约25000~30000 kPa。在地壳内SiO2和HF存在以下平衡:SiO2(s) +4HF(g)
根据题意完成下列填空:
(1)在地壳深处容易有________气体逸出,在地壳浅处容易有________沉积。
(2)如果上述反应的平衡常数K值变大,该反应________(选填编号)。
a. 一定向正反应方向移动
b. 在平衡移动时正反应速率先增大后减小
c. 一定向逆反应方向移动
d. 在平衡移动时逆反应速率先减小后增大
(3)如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时,________(选填编号)。
a. 2v正(HF)=v逆(H2O)
b. v(H2O)=2v(SiF4)
c. SiO2的质量保持不变
d. 反应物不再转化为生成物
(4)若反应的容器容积为2.0L,反应时间8.0 min,容器内气体的密度增大了0.12 g/L,在这段时间内HF的平均反应速率为________。
正确答案
(1)SiF4 、H2O;SiO2
(2)ad
(3)bc
(4)0.0010mol(L·min)
解析
本题考察外界条件对化学平衡的影响、化学平衡常数和化学平衡状态的的理解以及反应速率的有关计算。
(1)地壳深处温度低,使得平衡右移,会逸出SiF4、水蒸气气体;浅处温度高平衡左移动,析出SiO2沉淀。
(2)由于反应吸热,平衡常数K值变大,说明温度降低,则平衡正向移动,温度降低后逆反应速率开始要减小,由于平衡右移动,故逆反应速率又会逐渐增大直至到达新的平衡。
(3)平衡时a项v正(HF)= 2v逆(H2O),d项反应继续进行只是转化的生成物与分解的生成物相等。
(4)密度增大了0.12 g/L,说明质量增加了0.24g,即参加反应的SiO2为0.24g,其物质的量为0.004mol,则转化的HF为0.016mol,则HF的反应速率为
知识点
工业上采用乙苯与
其中乙苯在
(1)上述乙苯与

(2)①乙苯与
②下列叙述不能说明乙苯与
a。
c,消耗


(3)在3L密闭容器内,乙苯与




别改变了实验其他条件;乙苯的浓度随时间的变化如图I所示。
①实验I乙苯在0-50min时的反应速率为_______________
②实验Ⅱ可能改变条件的是__________________________
③图II是实验I中苯乙烯体积分数V%随时间t的变化曲线,请在图II中补画实验Ⅲ中苯乙烯体积分数V%随时间t的变化曲线。
(4)若实验I中将乙苯的起始浓度改为
正确答案
(1)
(2)
(每空2分 共4分)
(3)①
②加入催化剂
③
(4)减小(2分);0.225 (2分)
解析
略
知识点
碳、氮、硫是中学化学重要的非金属元素,在工农业生产中有广泛的应用。
(1)用于发射“天宫一号”的长征二号F火箭的燃料是液态偏二甲肼(CH3-NH-NH-CH3),氧化剂是液态四氧化二氮。二者在反应过程中放出大量能量,同时生成无毒、无污染的气体。已知室温下,1 g燃料完全燃烧释放出的能量为42.5kJ,请写出该反应的热化学方程式________。
(2)298K时,在2L的密闭容器中,发生可逆反应:2NO2(g)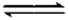
①298k时,该反应的平衡常数为________L ·mol-1。
②下列事实能判断该反应处于平衡状态的是________。
a.混合气体的密度保持不变
b.混合气体的颜色不再变化
c. V(N2O4)正=2V(NO2)逆
③若反应在398K进行,某时刻测得n(NO2)=0.6 mol n(N2O4)=1.2mol,则此时
V(正)________V(逆)(填“>”“<”或“=”)。
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。现向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。
试分析图中a、b、c、d、e五个点,
①水的电离程度最大的是________;
②其溶液中c(OH-)的数值最接近NH3·H2O的电离常数K数值的是________。
③在c点,溶液中各离子浓度由大到小的排列顺序是________。
正确答案
(1)C2H8N2(l)+2N2O4(l)=2CO2(g)+3N2(g)+4H2O(l) ΔH=-2550 kJ·mol-1
(2)①6.67;②b;③<
(3)①b;②d;③c(Na+)>c(SO)>c(NH)>c(OH-)=c(H+)
解析
略。
知识点
一定条件下,分别向容积固定的密闭容器中充入A和足量B,发生反应如下:
2A (g) +B (s) 
正确答案
解析
略
知识点
研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)利用反应:6NO2+8NH3
若在120℃时该反应在一容积为2L的容器内反应,20min时达到平衡,10min时电子转移了1.2mol,则0~10min时,平均反应速率υ(NO2)= 。
(2)一定条件下NO2与SO2可发生反应,其方程式为:
NO2(g)+SO2(g)
A、体系压强保持不变
B、混合气体颜色保持不变
C、SO3和NO的体积比保持不变
D、混合气体的平均相对分子质量保持不变
(3)若改变条件,使平衡常数变大,该反应 。
A、一定向正反应方向移动
B、在平衡移动时,正反应速率先减小后增大
C、一定向逆反应方向移动
D、在平衡移动时,逆反应速率先增大后减小
(4)CO可用于合成甲醇,反应方程式为CO(g) + 2H2(g)
CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应 (填“放热”或“吸热”)。实际生产条件控制在250℃、1.3×104 kPa左右,选择此压强的理由是: 。
正确答案
(1)0.015mol/L.min ;
(2)B
(3)A
(4)放热 在此压强下,CO转化率已很高,压强太高,会增加设备的成本。
解析
略
知识点
工业废水中常含有一定量的Cr2O72-和CrO42-,它们对人类及生态系统产生很大损害,必须进行处理后方可排放。常用的处理方法有两种。
方法1:还原沉淀法。
该法的工艺流程为:
其中第①步存在平衡:2 CrO42- (黄色)+2H+
(1)若第①步中平衡体系的pH=2,则该溶液显_________色;向该溶液中加入Ba(NO3)2溶液(已知BaCrO4为黄色沉淀)则平衡_________移动(填“向左”或“向右”或“不变”),溶液颜色将_________。
(2)能说明第①步反应达平衡状态的是_________(选填编号)
A.Cr2O72-和CrO42-的浓度相同
B.2υ(Cr2O72-)=υ(CrO42-)
C.溶液的颜色不变
(3)若改变条件使平衡状态的第①步反应向正反应方向移动,则该反应_________(选填编号)
A.平衡常数K值可以不改变 B.再达平衡前正反应速率一定大于逆反应速率
C.Cr2O72-的浓度一定增大 D.平衡移动时正反应速率一定先增大后减小
(4)第②步中,还原1 mol Cr2O72-离子,需要_________mol的FeSO4•7H2O。
(5)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s) 
方法2:电解法。
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解的进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(6)用Fe做电极的原因为___________________________。
(7)在阴极附近溶液pH升高的原因是(用电极反应解释)_________,溶液中同时生成的沉淀还有_______。
正确答案
(1)橙;向左;变浅
(2)C
(3)AB
(4) 6
(5) 5
(6)阳极反应为Fe-2e→Fe2+,提供还原剂Fe2+
(7)2H++2e→H2↑ Fe(OH)3
解析
略
知识点
“富煤、贫油、少气”是我国能源发展面临的现状。随着能源的日益紧张,发展“煤化工”对我国能源结构的调整具有重要意义。下图是煤化工产业链之一。

(1)已知:




则反应CO(g)+H2(g) +O2(g)= H2O(g)+CO2(g),ΔH= _______kJ/mol。在标准状况下,33.6 L的煤炭合成气与氧气完全反应生成CO2和H2O,反应过程中转移_______mol e-。
(2)在一恒容的密闭容器中,由CO和H2合成甲醇:CO(g)+2H2(g)
①下列情形能说明上述反应已达到平衡状态的是_______
a.体系压强保持不变
b.密闭容器中CO、H2、CH3OH(g)3种气体共存
c.CH3OH与H2物质的量之比为1:2
d.每消耗1 mol CO的同时生成2molH2
②CO的平衡转化率(α)与温度、压强的关系如右图所示。
A、B两点的平衡常数_______(填“前者”、“后者”或“一样”)大;
达到A、C两点的平衡状态所需的时间tA tC(填“大于”、“小于”或“等于”)。
在不改变反应物用量的情况下,为提高CO的转化率可采取的措施是_______(答出两点即可)。
(3)工作温度650℃的熔融盐燃料电池,是用煤炭气(CO、H2)作负极燃气,空气与CO2的混合气体为正极燃气,用一定比例的Li2CO3和Na2CO3低熔点混合物做电解质,以金属镍(燃料极)为催化剂制成的。负极的电极反应式为:CO+H2-4e-+2CO32-=3CO2+H2O;则该电池的正极反应式为_______。
正确答案
见解析。
解析
(1)-524.8 ; 3
(2)①a d
②一样 ; 大于
降温、加压、将甲醇从混合体系中分离出来
(3)
知识点
I.已知:C(s)+H2O(g)
一定温度下,在1.0 L密闭容器中放入1 mol C(s)、1 mol H2O(g)进行反应,反应时间(t)与容器内气体总压强(p)的数据见下表:
回答下列问题:
(1)下列哪些选项可以说明该可逆反应已达平衡状态 。
A.混合气体的密度不再发生改变 B.消耗1 mol H2O(g)的同时生成1 mol H2
C.ΔH不变 D.v正(CO) = v逆(H2)
(2)由总压强P和起始压强P0表示反应体系的总物质的量n总,n总=____ mol;由表中数据计算反应达平衡时,反应物H2O(g)的转化率α =_____(精确到小数点后第二位)。
Ⅱ.硫单质及其化合物在工农业生产中有着重要的应用。
(1)已知25℃时:xSO2 (g)+2xCO(g)=2xCO2 (g)+Sx (s) ΔH=ax kJ/mol
2xCOS(g)+xSO2 (g)=2xCO2 (g)+3Sx (s) ΔH=bx kJ/mol。
则反应COS(g)生成CO(g)、Sx (s)的热化学方程式是 。
(2)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中H2S、HS−、S2−的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如右图所示(忽略滴加过程H2S气体的逸出)。试分析:
①B曲线代表 分数变化(用微粒符号表示);滴加过程中,溶液中一定成立:
c(Na+)= 。
②M点,溶液中主要涉及的离子方程式 。
正确答案
I.(1)AD (2)P/P0 ; 79.82%(或0.80)
II.(1)①xCOS(g) = xCO(g)+ Sx(s) ; ΔH=0.5(bx-ax)kJ/mol
(2)①HS-; c(Na+)=3[c(H2S)+c(HS-)+c(S2-)](由物料守恒得出)
或c(Na+)= c(Cl-)+c(OH-)+c(HS-)+2c(S2-)-c(H+)(由电荷守恒得出)
②M:2S2-+3H+=HS-+H2S
解析
略
知识点
扫码查看完整答案与解析