- 化学反应原理
- 共2396题
我们学过的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡等,且均符合勒夏特列原理。
一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应
有关物质的量随时间的变化如图所示。
(1)0~2 min内的平均反应速率
平衡常数表达式为
(2),相同温度下,若开始加入
A,平衡常数
B,
C,达到平衡的时间
D,平衡时体系压强
(3)下列措施肯定能使平衡向逆反应方向移动的是的 ( )
A,充入少量氨气
B,降温至0℃
C,充入少量硫化氢
D,加压
(4)常温下,将
① 浓度为
② 
③ 
则a、b、c、d之间由大到小的关系是: 。
(5)常温下,取
表示醋酸溶液中pH变化曲线的是 (填“A”或“B”);设盐酸中加入的Zn质量为



(6)某温度时,在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如下图所示,有关粒子浓度关系的比较正确的是
A,在A、B间任一点,溶液中一定都有
B,在B点,
C,在C点:
D,在D点:
正确答案
(1)0.1mol/(L·min)
(2)BD
(3)A
(4)b>a=d>c
(5)B,<
(6)D
解析
略
知识点
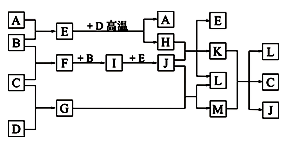
某小组根据工业生产原理设计如下转化关系,以获取烧碱和金属钛(Ti)。
(1) 燃料电池中通入氧气的电极是 (填“正”或“负”)极,电极反应式是 ;用该电池电解饱和食盐水,若消耗32 g甲醇,理论上Ⅰ中可生成NaOH ________mol。
(2)如图所示,理论上加入Ⅱ中的TiO2和焦炭的物质的量之比是 ;由TiCl4得到金属Ti的化学方程式是 。
(3)根据Ⅲ中合成甲醇的反应,该小组保持温度不变,在两个相同的恒容密闭容器中进行实验,有关实验数据如下:
① P1 4MPa(填“>”、“<”或“=”);
② 实验Ⅰ条件下合成甲醇的热化学方程式是 。
正确答案
见解析。
解析
(1)正 
(2)1﹕2
(3)①<
②
知识点
已知2SO2(g)+ O2(g)

正确答案
解析
略
知识点
一定条件下存在反应:CO(g)+H2O(g)
正确答案
解析
略
知识点
10.已知工业生产硫酸过程中,2SO2(g) + O2(g)
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28.工业上一般在密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g) 
(1)不同温度下的平衡转化率与压强的关系如图所示。
① 该反应ΔH________(填“>”或“<”,下同)0,ΔS________0,则该反应________(填“一定能”“一定不能”或“不一定”)自发进行。
② 实际生产条件控制在250℃、1.3×l04kPa左右,选择此压强的理由是( )。
(2)某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.1mol/L。
① 该反应的平衡常数K=( )。
② 在其他条件不变的情况下,将容器体积压缩到原来的1/2,与原平衡相比,下列有关说法正确的是( )(填字母)。
a. 氢气的浓度减少
b. 正反应速率加快,逆反应速率也加快
c. 甲醇的物质的量增加
d. 重新平衡时,n(H2)/n(CH3OH)增大
③ 若保持同一反应温度将起始物质改为amol CO、bmol H2、cmol CH3OH,欲使平衡混合物中各组成与原平衡相同,则a、b应满足的关系为____________________,且欲使开始时该反应向逆反应方向进行,c的取值范围是( )。
正确答案
(1)①<<不一定②该压强下,CO转化率已较高(90%左右),再增大压强,CO转化率提高不大,且生产成本增加
(2)① 6.25 ② bc ③ a+c=2和b+2c=6或b=2+2a1.8<c≤2
解析
解析已在路上飞奔,马上就到!
知识点
26.在一个固定体积的密闭容器中,向容器中充入2 mol A 和1 mol B,发生如下反应:2A(g) + B(g) 
(1)若使容器温度升高,平衡时混合气体的平均相对摩尔质量减小,则正反应为( ) (填“吸热”或“放热”)反应.
(2)若维持容器体积和温度不变,按下列方法加入起始物质,达到平衡时C的浓度仍为1.2 mol/L的是( ) (用序号填空).
①4 mol A+2 mol B ②3 mol C+1 mol D+l mol B
③3 mol C+2 mol D ④1.6 mol A+0.8 mol B+0.6 mol C
(3)某温度下,向容器中加入3 mol C和0.8 mol D,反应达到平衡时C的浓度仍为1.2 mol/L,则容器的容积V应大于( )L,小于( )L.
正确答案
(1)吸热
(2)③
(3)0.52.5
解析
解析已在路上飞奔,马上就到!
知识点
9、在体积、温度都相同的条件下有下列反应:2A(g)+2B(g) C(g)+3D(g)。现分别从两条途径建立平衡:Ⅰ.A、B的起始物质的量均为2mol,Ⅱ.C、D的起始物质的量分别为2mol和6mol。以下叙述中不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
26.如图,常温下单质A、B为气体,单质C为固体,它们依次分别由短周期元素甲、乙、丙组成,甲元素原子核外电子数等于其电子层数,乙、丙同主族;E常温下为液体,G、H为黑色固体,D是常见金属(反应条件多数略去)。
回答下列问题:
(1)化合物E的沸点高于化合M的沸点,原因是( )。
(2)甲、乙两种元素可以形成两种化合物,其中一种化合物含有4个原子核,该化合物的结构式为( )。
(3)E与D高温反应的化学方程式为 ( ) 。
K与M在水溶液中反应的离子方程式为( )。
(4)实验室在保存L溶液时,需加入少量D,理由是( ) 。实验室检验L水溶液中的阳离子的方法是 ( )。
(5)已知一定条件下,每1 mol F与单质B完全反应生成I放出热量98.0 kJ,若2 mol F与1 mol B在此条件下发生反应,达平衡时,放出热量为176.4 kJ,则F的转化率为( )。若保持温度和压强不变(反应混合物都为气体)按下列四种配比作为起始物质充入,达到平衡时各物质的物质的量与上述平衡状态相同的是( )。
① 4 mol F、2 mol B ② 2 mol F、2 mol B、2 mol I
③ 1 mol F、0.5 mol B、1 mol I ④ 3 mol I、1mol Ne
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
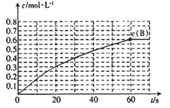
27. 298K时,某容积固定为1L的密闭容器中发生如下可逆反应:A(g)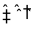
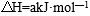
回答下列问题:
(1)前60s内A的平均反应速率为( )mol/(L·s)。
(2)若B的平衡浓度为A的3倍,则A的转化率为( ),在70s时再向容器中通入一定量的A气体,再次达到平衡时A的转化率将( )(选填“不变”或“变大”或“变小”)。
(3)其他条件不变,反应在323K进行,B的平衡浓度为A的2倍,且达到平衡所需时间为298K时的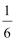
①该反应的△H ( ) 0(填“>”或“<”)
②请在图中画出323K时A的物质的量浓度随时间的变化曲线。
(4)若反应在298K进行,在2L密闭容器中加入1molB、0.2molNe,达到平衡B的转化率为( ) 。
a.等于60%
b.等于40%
c.小于40%
d.介于40%—60%之间
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
15.一定条件下存在反应:2SO2(g)+O2(g)
正确答案
解析
本题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。
知识点
11.在恒温时,一固定容积的容器内发生如下反应:2NO2(g)
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
15.一定条件下存在反应:2SO2(g) + O2(g)
正确答案
解析
本题只有一个或两个选项符合题意,若正确答案只包括一个选项,多选时,该小题得0分,若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。
知识点
甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸汽重整。向反应系统同时通入甲烷.氧气和水蒸气,发生的主要化学反应有:
回答下列问题:
(1)反应CO(g)+H2O(g)
(2)在初始阶段,甲烷蒸汽重整的反应速率 甲烷氧化的反应速率(填大于.小于或等于)。
(3)对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)也可以平衡常数(记作KP),则反应CH4(g)+H2O(g)
随着温度的升高,该平衡常数 (填“增大”.“减小”或“不变”)。
(4)从能量阶段分析,甲烷自热重整方法的先进之处在于 。
(5)在某一给定进料比的情况下,温度.压强对H2和CO物质的量分数的影响如下图:
①若要达到H2物质的量分数>65%.CO的物质的量分数<10%,以下条件中最合适的是 。
(a)600℃,0.9Mpa
(b)700℃,0.9MPa
(c)800℃,1.5Mpa
(d)1000℃,1.5MPa
②画出600℃,0.1Mpa条件下,系统中H2物质的量分数随反应时间(从常温进料开始计时)
的变化趋势示意图:
(6)如果进料中氧气量过大,最终导致H2物质的量分数降低,原因是 。
正确答案
见解析。
解析
(1)根据盖斯定律,由蒸汽重整的两个反应不难得出该反应的△H=-41.2kJ/mol
(2)由于甲烷氧化的活化能低于蒸汽重整的活化能,所以蒸汽重整速率小于甲烷氧化速率。
(3)Kp=
(4)由于放热的甲烷氧化产生的热量可以供给吸热的蒸汽重整,提高了能源的利用率。
(5)简单读图,条件B同时符合“H2物质的量分数>65%.CO的物质的量分数<10%”;
作图的关键是找准零时刻起点位置,反应过程中的变化趋势以及平衡以后的终点位置,氢气不是原料气,即开始时刻氢气含量为0,由图中可以读出600℃,0.1Mpa条件下,平衡系统中H2物质的量分数为70%,因此不难作图如下:
(6)甲烷氧化程度过高,氢气会和氧气反应。
知识点
在一定条件下,N2O分解的部分实验数据如下:
下图能正确表示该反应有关物理量变化规律的是
(注:图中半衰期指任一浓度N2O消耗一半时所需的相应时间,c1、c2均表示N2O初始浓度且c1<c2)
正确答案
解析
略
知识点
扫码查看完整答案与解析