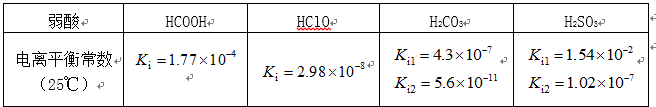- 化学反应原理
- 共2396题
下表中评价合理的是
正确答案
解析
A项注意的是HNO3把+2价的铁也氧化为+3价了,但HNO3应还原为NO气体,故A项评价错误;B项的碳酸镁为微溶物,写离子方程式时应保持化学式;B项评价正确;C项的离子方程式错误,正确为2NH4+ +SO42-+Ba2++2OH-=BaSO4↓+2NH3·H2O;D项的反应是正确的,故D项评价错误。
知识点
向盛KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。
完成下列填空:
(1)写出并配平CCl4层由紫色变成无色的化学反应方程式(如果系数是1,不用填写):
(2)整个过程中的还原剂是______________________________________。
(3)KI换成KBr,则CCl4层变为____________色;继续滴加氯水,CCl4层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是____________________________________。
(4)加碘盐中含碘量为20mg~50mg/kg。制取加碘盐(含KIO3的食盐)1000k9,若用KI与 Cl2反应制KIO3,至少需要消耗Cl2___________________L(标准状况,保留2位小数)。
正确答案
(1)I2 + 5Cl2 + 6H2O→2HIO3 + 10HCl
(2) KI、I2
(3)红棕 HBrO3>Cl2>HIO3
(4) 10.58
解析
略
知识点
若(NH4)2SO4在强热时分解的产物是SO2、N2、NH3和H2O,则该反应中化合价发生变化和未发生变化的N原子数之比为
正确答案
解析
略
知识点
27.A:请回答
(1)H2O2的电子式___________。
(2)镁燃烧不能用CO2灭火,用化学方程式表示其理由________________。
(3)在AgCl沉淀中加入KBr溶液,白色沉淀转化为淡黄色沉淀,写出反应的离子方程式_____________。
(4)完成以下氧化还原反应的离子方程式:
( )MnO4-+( )C2O42-+______=( )Mn2++( )CO2↑+________
B:化合物甲和NaAlH4都是重要的还原剂。一定条件下金属钠和H2反应生成甲。甲与水反应可产生H2,甲与AlCl3反应可得到NaAlH4。将4.80g甲加热至完全分解,得到金属钠和2.24 L(已折算成标准状况)的H2。
请推测并回答:
(1)甲的化学式__________。
(2)甲与AlCl3反应得到N
(3)NaAlH4与水发生氧化还原反应的化学方程式__________。
(4)甲在无水条件下可作为某些钢铁制品的脱锈剂(铁锈的成分表示为Fe2O3),脱锈过程发生反应的化学方程式 ( )。
(5)某同学认为:用惰
判断该同学设想的制备和验纯方法的合理性并说明理由___________。
正确答案
A:
(1) 

(3) AgCl + Br-== AgBr + Cl-
(4) 2MnO4- + 5C2O42- + 16H+ == 2Mn2+ + 10CO2↑+ 8H2O
B:
(1)NaH (2) 4NaH+AlCl3==NaAlH4+3NaCl
(3) NaAlH4+2H2O==NaAlO2+4H2↑ (4) 3NaH+Fe2O3==2Fe+3NaOH
(5) 制备过程不合理,因为盐酸易挥发,H2中混有HCl,导致产物中有NaCl
验纯方法不合理,如果有Na残留,Na与水反应也产生H2;没有考虑混入的NaCl
解析
解析已在路上飞奔,马上就到!
知识点
二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂。
(1)氯化钠电解法是一种可靠的工业生产ClO2方法。
①用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO等杂质。其次除杂操作时,往粗盐水中先加入过量的 (填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的SO,其原因是 。【已知:Ksp(BaSO4)= 1.1 ×10—10 Ksp(BaCO3)= 5.1 ×10—9】
②该法工艺原理如图。其过程是将食盐水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸反应生成ClO2。
工艺中可以利用的单质有 (填化学式),发生器中生成ClO2的化学方程式为 。
(2)纤维素还原法制ClO2是一种新方法,其原理是:纤维素水解得到的最终产物D与NaClO3反应生成ClO2。完成反应的化学方程式:
(3)ClO2和Cl2均能将电镀废水中的CN—氧化为无毒的物质,自身被还原为Cl—。处理含CN—相同时的电镀废水,所需Cl2的物质的量是ClO2的 倍
正确答案
解析
(1)①BaCl2 BaSO4和BaCO3的Ksp相差不大,当溶液中存在大量CO32 -时,BaSO4(s)会部分转化为BaCO3(s)(或其它合理答案)
② H2、Cl2 2NaClO3 + 4HCl 
(2)1 C6H12O6 + 24 NaClO3 + 12H2SO4 
(3)2.5
知识点
用含有A1203、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O。,工艺流程如下(部分操作和条件略):
Ⅰ。向铝灰中加入过量稀H2SO4,过滤:
Ⅱ。向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ。加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
Ⅳ。加入MnSO4至紫红色消失,过滤;
Ⅴ。浓缩、结晶、分离,得到产品。
(1)H2S04溶解A1203的离子方程式是
(2)KMnO4 - 氧化Fe2+的离子方程式补充完整:
(3)已知:
生成氢氧化物沉淀的pH
根据表中数据解释步骤Ⅱ的目的:
(4)己知:一定条件下,MnO4 - 可与Mn2+反应生成MnO2,
① 向 Ⅲ 的沉淀中加入浓HCI并加热,能说明沉淀中存在MnO2的现象是 .
② Ⅳ 中加入MnS04的目的是
正确答案
答案:
(1)
(2)5、8H+、5、4H2O;
(3)将Fe2+氧化为Fe3+,调节pH值使铁完全沉淀;
(4)①、生成有黄绿色气体;
②、加入MnSO4,除去过量的MnO4-。
解析
(1)氧化铝与硫酸反应生成硫酸铝与水;
(2)反应中MnO4-→Mn2+,Fe2+→Fe3+, MnO4-系数为1,根据电子转移守恒可知, Fe2+系数为
(3)滤液中含有Fe2+,由表中数据可知,Fe(OH)2开始沉淀的pH大于Al(OH)3 完全沉淀的pH值,而Fe(OH)3完全沉淀的pH值小于Al(OH)3开始沉淀的pH值,pH值约为3时,Al3+、Fe2+不能沉淀,步骤Ⅱ是将Fe2+氧化为Fe3+,调节pH值使铁完全沉淀;
(4)①、MnO2能将HCl氧化为Cl2,若有黄绿色气体生成说明沉淀中存在MnO2;
②、Ⅲ 的上层液呈紫红色,MnO4-过量,加入MnSO4,除去过量的MnO4-。
知识点
已知氧化性Br2>Fe3+。FeBr2溶液中通入一定量的Cl2,发生反应的离子方程式为:
a Fe2++b Br-+c Cl2→d Fe3++ e Br2+ f Cl-
下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是
正确答案
解析
略
知识点
二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。
完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1,写出Se和浓HNO3的反应方程式________。
(2)已知:Se+2H2SO4(浓)→2SO2↑+SeO2+2H2O
2SO2+SeO2+2H2O→Se+2SO42-+4H+
SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是______。
(3)回收得到的SeO2的含量,可以通过下面的方法测定:
①SeO2+KI+HNO3→Se+I2+KNO3+H2O
②I2+2Na2S2O3→Na2S4O6+2NaI
配平方程式①,标出电子转移的方向和数目。
(4)实验中,准确称量SeO2样品0.1500g,消耗了0.2000 mol/L的Na2S2O3溶液25.00 mL,所测定的样品中SeO2的质量分数为___。
正确答案
(1)Se+2HNO3(浓)→H2SeO3+NO↑+NO2↑ ;
(2)H2SO4(浓)>SeO2>SO2
(3) 
(4)0.925
解析
利用题中信息可知Se与浓HNO3反应,Se被氧化为+4价的H2SeO3,HNO3还原为NO与NO2,利用电子守恒和限定条件(生成NO与NO2的物质的量之比为1:1,即二者计量系数比为1:1)可得方程式。利用氧化性:氧化剂>氧化产物,结合题中方程式可知氧化性:H2SO4(浓)>SeO2>SO2。在反应①I-失电子,转移SeO2,+4价Se得到电子还原为单质Se。利用前面配平的方程式可得关系式:SeO2~2I2~4Na2S2O3,故样品中SeO2的质量分数为:[111g·mol-1×(0.2000mol/L×0.025L)/4]/0.1500g=0.925。
知识点
部分弱酸的电离平衡常数如下表:
(1)在温度相同时,各弱酸的Ki值与酸性的相对强弱的关系为:________________________。
(2)下列离子方程式正确的是
A,2ClO- + H2O + CO2 → 2HClO + CO32-
B,2HCOOH + CO32- → 2HCOO- + H2O + CO2↑
C,H2SO3 + 2HCOO- → 2HCOOH + SO32-
D,Cl2 + H2O+2CO32- → 2HCO3- + Cl- + ClO-
(3)常温下,pH=3的HCOOH溶液与pH=11的NaOH溶液等体积混合后,溶液中离子浓度由大到小的顺序为 。
亚硒酸(H2SeO3)也是一种二元弱酸,常温下是一种无色固体,易溶于水,有较强的氧化性。
(4)往亚硒酸溶液中不断通入SO2 会产生红褐色单质,写出该反应的化学方程式: 。
(5)将亚硒酸与30%的H2O2加热可制得硒酸(H2SeO4),反应方程式如下:
H2SeO3 + H2O2 → H2SeO4+H2O,下列说法中正确的是
A,H2O2既是氧化剂又是还原剂
B,H2O 既不是氧化产物又不是还原产物
C,H2SeO4既是氧化产物又是还原产物
D,氧化性:H2SeO3>H2SeO4
碲酸(H6TeO6)是一种很弱的酸,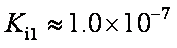
HI+ H6TeO6
(6)若反应中生成的TeO2与Te的物质的量之比为
正确答案
(1)Ki值越大,酸性越强
(2)BD
(3)C(HCOO—)>C(Na+)>C(H+)>C(OH—)
(4)H2SeO3 + 2SO2 +H2O → Se ↓+ 2H2SO4
(5)C
(6)8HI + 2H6TeO6 → TeO2 + Te +4I2 + 10H2O
解析
略
知识点
银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下的:
(1)点解精练银时,阴极反应式为 ;滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,该气体变色的化学方程式为
(2)固体混合物B的组成为 ;在省城固体B的过程中,余姚控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为 。
(3)完成煅烧过程中一个反应的化学方程式:
(4)若银铜合金中铜的质量分数为63.5%,理论上5.0kg废料中的铜可完全转化为 mol CuAlO2,至少需要1.0mol·L-1的Al2(SO4)3溶液 L.
(5)CuSO2溶液也可用于制备胆矾,其基本操作时 、过滤、洗涤和干燥。
正确答案
(1)Ag++e-=Ag 2NO+O2=2NO2
(2)Al(OH)3和CuO的混合物 Al(OH)3+OH-=AlO2-+2H2O
(3)4 2 4 O2
(4)50 25
(5)蒸发浓缩、冷却结晶
解析
本题考查了工艺流程问题。
(1)电解精炼时,阴极上Ag+得电子生成金属银,电极反应式为Ag++e-=Ag;气体迅速变红是因为生成的NO气体被空气氧化为NO2,2NO+O2=2NO2。
(2)Al2(SO4)3和CuSO4溶液中加入NaOH溶液后得到的固体为Al(OH)3和Cu(OH)2的混合物,但是煮沸后,氢氧化铜在80度即分解,故应该为氢氧化铝和氧化铜的混合物;在该过程中加入的NaOH过量后会使生成的Al(OH)3溶解,反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O。
(3)在该未完成的方程式中,产生的气体只能是氧气,故配平后的方程式为4CuO+2Al2O3=4CuAlO2+O2↑。
(4)根据铜守恒可知n(CuAlO2)=
(5)从硫酸铜溶液中得到晶体的过程为,蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
知识点
MnO2是一种重要的无机功能材料,粗MnO2的提纯是工业生产的重要环节。某研究性学习小组设计了将粗MnO2(含有较多的MnO和MnCO3)样品转化为纯MnO2实验,其流程如下:
(1)第①步中所用的稀H2SO4浓度为20%,用98%的硫酸配制该浓度的硫酸,所需的玻璃仪器除量筒、玻璃棒外,还有 。
A、容量瓶 B、烧杯 C、烧瓶 D、锥形瓶
(2)、第①步加稀H2SO4时,粗MnO2样品中的 _____ (写化学式)转化为可溶性物质。
(3)第②步反应的离子方程式:






(4)第③步蒸发操作必需的仪器有铁架台(含铁圈)、酒精灯 _________ 。
(5)实验室中NaClO3 可由Cl2 与热的NaOH反应来制取,反应的方程式为:_______
3Cl2 +6NaOH →NaCl+NaClO3+3H2O,从混合液中获得较多的NaClO3晶体的实验操作依次
为____ 、 _____ 、过滤洗涤。相关物质的溶解度表见下图:
(6)若粗MnO2样品的质量为12.69g,第①步反应后,经过滤得到8.7g MnO2,
并收集到0.224LCO2(标准状况下),则在第②步反应中至少需要 _____ mol NaClO3。
正确答案
(1)B
(2)MnO MnCO3
(3)5Mn2++2ClO3―+4H2O →5MnO2+Cl2↑+8H+
(4)蒸发皿、玻璃棒;
(5)蒸发浓缩、冷却结晶
(6)0.02
解析
略
知识点
为了防止枪支生锈,常将枪支的钢铁零件放在NaNO2和NaOH的混合液中进行化学处理使钢铁零件表面生成Fe3O4的致密的保护层——“发蓝”。其过程
① 3Fe



② Na2FeO2



③ Na2FeO2



(1)配平化学方程式②。
(2)上述反应①中还原剂为 ,被还原的是 。若有1mol Na2FeO2生成,则反应中有 mol电子转移。
(3)关于形成“发蓝”的过程,下列说法正确的是
A,该生产过程不会产生污染
B,反应③生成的四氧化三铁具有抗腐蚀作用
C,反应①②③均是氧化还原反应
D,反应①②中的氧化剂均为NaNO2
(4)当NaOH溶液浓度过大,“发蓝”的厚度会变小,其原因是: 
正确答案
(1) 6,1,5,3,1,7
(2)Fe 
(3)BD
(4)反应③可逆,氢氧化钠浓度过大,平衡向逆反应方向移动
解析
略
知识点
XeO3是一种不稳定的物质,具有强氧化性。
(1)配平反应的离子方程式:____XeO3



(2)反应现象为:①有气泡产生,② 。
(3)发生氧化反应的物质是 。
(4)将适量的XeO3投入



正确答案
(1) 5,6,9,6,5,18
(2)溶液显紫红色
(3)Mn2+
(4)0.015 pH = 1
解析
略
知识点
空气质量与我们的健康息息相关,目前我国通过监测6项污染物的百分比浓度计算空气质量指数(AQI),SO2、NO2和CO是其中3项中的污染物。
(1)上述3种气体直接排入空气后会引起酸雨的气体有 __________ (填化学式)。
(2)早期人们曾经使用铅室法生产硫酸,其主要反应为:
SO2(g)+NO2(g)
①若已知2SO2(g)+O2(g)

则SO2(g)+NO2(g)
②一定温度下,向固定体积为2 L的密闭容器中充入SO2和NO2各1 mol,发生反应:
SO2(g)+NO2(g)
a.体系压强保持不变 b.混合气体的颜色保持不变
c.NO的物质的量保持不变 d.每生成1 mol SO3的同时消耗1 mol NO2
(3)矿石燃料的燃烧是造成酸雨的主要因素之一 。而甲醇日趋成为重要的有机燃料,通常利用CO和H2 合成甲醇,其反应的化学方程式为CO(g)+ 2H2(g)
① 上述合成甲醇的反应为 _________ 反应(填“放热”或“吸热”)。
②A、B、C三点的平衡常数KA、KB、KC的大小关系为 ______________ 。
铁是人体中必需微量元素中含量最多,体内缺失会引起贫血。含FeO42-离子的盐具有强氧化性,能杀菌消毒,如高铁酸钾是一种新型、高效的消毒剂及绿色净水剂。铁及其化合物之间的相互转化可用下式表示:

请回答下列有关问题:
(4)Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液实现上述①的转化,要求产物纯净。可选用的试剂是_________(选填序号);
a.Cl2 b.Fe c.HNO3 d.H2O2
(5)上述转化得到的硫酸铁可用于电化浸出黄铜矿精矿工艺。精矿在阳极浸出的反应比较复杂,其中有一主要反应:CuFeS2+4Fe3+→Cu2++5Fe2++2S,
则下列说法正确的是_________(选填序号);
a.反应中,所有铁元素均被还原
b. 从物质的组成看,黄铜矿属于复盐
c.反应中,CuFeS2既作氧化剂又作还原剂
d.当转移1 mol 电子时,有46 g CuFeS2参加反应
(6)下列是工业制取高铁酸钾的一种方法,请在方框内填上合适的微粒符号并配平该离子方程式:__Fe3+ +__
正确答案
(1)SO2、NO2
(2) 
(3)①放热 ②KA=KB>KC
(4)d
(5)d
(6)2_Fe3+ +_16_OH-+_3_Cl2→ _2_FeO42-+_6_NO3-+ 6Cl- +8H2O
解析
略
知识点
卤素单质及其化合物在生产和生活中有广泛应用。
Ⅰ、氟化钠主要用作农作物杀菌剂、杀虫剂、木材防腐剂。实验室以氟硅酸(
已知:20℃时氯化铵的溶解度为37.2 g,氟化钠的溶解度为4 g,Na2SiF6微溶于水。
请回答下列有关问题:
(1)完成并配平上述流程中①、②的化学反应方程式:
② 。
(2)操作Ⅲ分为两步,其顺序是 (填写所选序号)。
a、过滤 b、加热浓缩 c、冷却结晶 d、洗涤
操作Ⅱ是洗涤、干燥,其目的是 ,在操作Ⅰ~V中与之相同的操作步骤是 。
(3)流程①中NH4HCO3必须过量,其原因是 。
Ⅱ、紫菜与海带类似,是一种富含生物碘的海洋植物,可用于食用补碘。以下为某兴趣小组模拟从紫菜中提取碘的过程:
已知:商品紫菜轻薄松脆,比海带更易被焙烧成灰(此时碘转化为碘化物无机盐)。
(4)将焙烧所得的紫菜灰与足量的双氧水和稀硫酸作用,写出反应的离子方程式:
。
(5)操作①中涉及两步操作,名称是 ,所用的主要玻璃仪器为 ,所用试剂A最好选用表格中的 (填试剂名称)。
(6)将下列装置图中缺少的必要仪器补画出来,以最终将单质碘与试剂A分离:
正确答案
(1)
(2)be(1分) ; 除去氟化钠表面的氯化铵等可溶性杂质(1分) ; V(1分)
(3)使氟硅酸完全反应,避免析出Na2SiFe而混入杂质(1分)
(4)
(5)过滤;烧杯;碘
(6)
解析
略
知识点
扫码查看完整答案与解析