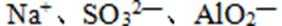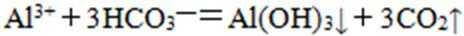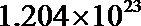- 化学反应原理
- 共2396题
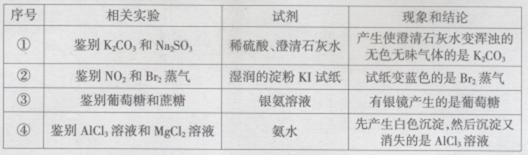
9.下列实验所用试剂、现象和结论均正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
8.下列叙述中正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
26.某溶液中的溶质由下列中的几种离子构成:Na+、Fe3+、Cu2+、Ba2+、AlO2-、CO32-、SO32—、SO42—。取该溶液进行有关实验,实验步骤及结果如下:
①向溶液中加入过量稀盐酸,得到气体甲和溶液甲;
②向溶液甲中加入过量NH4HCO3溶液,得到白色沉淀乙、气体乙和溶液乙;
③向溶液乙中加入过量Ba(OH) 2溶液,得到白色沉淀丙、气体丙和溶液丙。
④检验气体甲、气体乙、气体丙,都只含有一种成份,而且各不相同。
请回答下列问题:
(1)只根据实验①能得出的结论是:____________________________;
(2)沉淀丙中一定含有:_________________,可能含有:_________________;
(3)该溶液中肯定存在的离子有:___________________________;
(4)气体乙分子的结构式为:_________________;
(5)向溶液甲中加入NH4HCO3溶液至过量,该过程中可能发生反应的离子方程式为_________________;_________________;_________________(根据需要,可不填完,也可补充)。
正确答案
(1)至少含有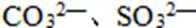
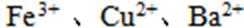
(2)BaCO3; BaSO4
(3)
(4)O=C=O
(5)
解析
解析已在路上飞奔,马上就到!
知识点
8.新型固体LiFePO4隔膜电池广泛应用于电动汽车。电池总反应为: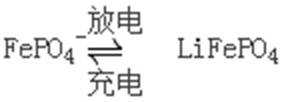
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28.一氧化碳和氢气是重要的化工原料,可以用于合成甲醇、二甲醚、甲酸甲酯等。
(1)已知某温度下热化学方程式:
(2)如图所示是某乙醇燃料电池工作时的装置,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少。
①加入氧气的铂电极的电极反应式为______________。
②在此过程中,乙池中某一电极析出金属银4.32 g时,甲池中理论上消耗氧气_________L(标准状况下)。
③电解结束后,甲池中溶液的pH____,乙池中溶液的pH_______ (填写“变大”、“变小”或“不变”),
若想恢复乙池中原有溶液的浓度应向乙池中加入适量的___________。
正确答案
(1)-221.51
(2)
①O2+4e-+2H2O=4OH-
②0.224
③ 变小 变小 BC
解析
解析已在路上飞奔,马上就到!
知识点
10.下列有关NaClO和NaCl混合溶液的叙述正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
25.有4.8 g CuO、Fe2O3混合物跟足量CO充分反应后固体减少1.28 g,反应后全部气体用0.6 mol·L-1 Ba(OH)2溶液100 mL吸收。下列有关叙述中正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
7. 已知单位体积的稀溶液中,非挥发性溶质的分子或离子数越多,该溶液的沸点就越高。则下列溶液沸点最高的是:( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
12.简单化合物HB在水中达到电离平衡时各种微粒的浓度如下表(25°C):
分析表中①至⑥的数据,下列说法不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
7.现有两瓶温度分别为15℃和35℃,pH均为1的硫酸溶液,下列有关说法错误的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28.(1)已知25℃时有关弱酸的电离平衡常数:
①同温度下,等pH值的
顺序为_________________(填序号)
②25℃时将20 mL 0. 1 mol/LCH3COOH溶液和20 mL0. 1 mol/L HSCN溶液分别与20 mL 0.1 mol/LNaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示。反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是_______________________。反应结束后所得两溶液中,c (SCN-)__________________(填“>”“<”或"=")c( CH3COO-)。
③若保持温度不变,在醋酸溶液中加入一定量氨气,下列量会变小的是__________(填序号)。

(2)煤燃烧产生的烟气也含氮的氧化物,用CH4催化还原NOx,可以消除撅级化物的污染。
写出CH4 催化还原N2O4(g) 生成N2(g),CO2(g)和H2O (I)的热化学方程式_______________________________。
(3)甲烷燃料电池可以提升能量利用率。如图是利用甲烷燃料电池电解50ml 2mol/L的氯化铜溶液的装置示意图,请回答下列问题:(已知相时原子质量:N14 O16 Cu 64 H 1)
①甲烷徽料电池的负极反应式是_______________。
②当A中消耗0.15 mol氧气时,B中_____________极增重__________________g。
正确答案
(1)
①abc
②相同温度下HSCN比CH3COOH的电离平衡常数大,同浓度时电离出的氢离子浓度大,与NaHCO3溶液反应快 >
③b
(2)
(3)①
解析
解析已在路上飞奔,马上就到!
知识点
27. 铜是一种重要的战略物资,以黄铜矿(主要成分是CuFeS2)为主要原料生产铜、铁 红、单质硫时,原料的综合利用率较高,其主要流程如图所示(已知Na[CuCl2]〕的电离方程式为
(1)流程中粉碎的目的是______________________________________,操作①、②、
③、④的目的相同,在实验中这种操作的名称是___________________。
(2)铁红的重要用途:_________________________________,固体B将有两种产物,一种是单质C、另一种是原子个数比为1:1的一种金属的低价态盐,写出堆浸时反应的化学
方程式___________________。
(3)反应V的离子方程式为_________________。
(4)此方法中得到的铜纯度不能满足某些生产的需要,需要利用电解法进行提纯。若用如图所示的装置进行电解精炼,则乙中溶液的溶质是________。e电极上的电极反应式为__________________。若当电路中有2 mol电子通过时,乙中某个电极质量减轻了63.92g,则粗铜的纯度为_________(己知相对原子质量:Fe56 Cu 64)(假设杂质只有铁且精炼时铜与铁的放电比例与混合物比例相同。计算时用%表示保留一位小数)。
正确答案
(1)增大反应物间的接触面积,有利于充分、快速的反应 过滤
(2)生产油漆、铁盐
(3)
(4)CuSO4 
解析
解析已在路上飞奔,马上就到!
知识点
12.下列有关电解质溶液的说法正确的是
正确答案
解析
A. 电荷守恒c(OH﹣)+c(HS﹣)+2c(S2﹣)=c(H+)+c(Na+),物料守恒c(Na+)=2[c(S2-)+c(HS﹣)+c(H2S)],然后由两式相加抵消掉c(Na+)得到质子守恒c(OH﹣)=c(H+)+c(HS﹣)+2c(H2S),A错误。
B. NaHCO3 + NaOH = Na2CO3 +H2O 故可以将其看成Na2CO3溶液,Na2CO3 = Na+ + CO32-,CO32-第一步水解:CO32-+ H2O = HCO3- + OH﹣,第二步水解:HCO3- + H2O = H2CO3 + OH﹣,第一步水解大于第二步水解程度,故:C(Na+)>c(CO32-)>c(HCO3- )>c(OH-) ,碳酸钠溶液显碱性c(OH-) >c(H+) ,故B正确。
考查方向
解题思路
而且溶液中的各种守恒。
易错点
1、电荷守恒与物料守恒的应用。
2、溶液中存在的平衡体系。
知识点
废旧电池的回收利用,既能减少废旧电池对环境的污染,又能实现废旧电池的资源化利用。下图是某科技小组,以废旧锌锰干电池为原料,回收及制备多种用途的碳酸锰和相关物质的主要流程:
23.灼烧黑色粉末变成黑褐色是因为有少量MnO2发生了反应生成了少量的MnO,其可能的反应方程式为: 。
24.还原过程是先加入稀硫酸再加入草酸,写出反应化学方程式: ;在该过程中小组成员甲发现加入硫酸部分固体溶解剩余黑色固体,接着他没有加入草酸而是加入一定量的双氧水,发现固体也完全溶解了,成员乙在加硫酸后也没有加草酸,他又加入了一定量氨水,无明显变化,测得这时溶液的PH值为9,他接着又加入双氧水,发现黑色固体不减反增,写出导致固体增加的离子方程式: ;比较甲、乙两位组员实验你得出的结论是: 。
25.操作1和操作2使用到相同的装置,操作3的名称是 。
26.硫酸锰转化为碳酸锰的操作是,在60摄氏度下调节PH值后加入碳酸氢铵溶液,直到不再有气泡产生后再加热反应1小时,写出反应的化学方程式: 。
27.已知锌锰干电池的总反应为Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl +2MnOOH ,写出电池正极的电极 ;电解MnSO4溶液回收锰的阳极的电极反应式: 。
正确答案
2MnO2+C=2MnO+CO2↑或MnO2+C=MnO+CO↑
解析
灼烧黑色粉末变成黑褐色是因为有少量MnO2发生了反应生成了少量的MnO,其可能的反应方程式为:2MnO2+C=2MnO+CO2↑或MnO2+C=MnO+CO↑。
考查方向
解题思路
本题考查了化学与技术、原电池原理、电极方程式的书写,综合性较强.
①根据电池反应判断正负极和电解质;二氧化锰和铵根离子在正极发生反应;
②根据碱性锌锰电池的特点分析;
①根据电池的材料分析;
②根据已知反应物和产物,再利用元素守恒
③K2MnO4溶液中阴极产物的判断,根据溶液中阳离子得电子能力分析.
易错点
1、二氧化锰和铵根离子在正极发生反应。
2、电解MnSO4溶液回收锰的阳极产物的判断。
正确答案
MnO2+H2C2O4+H2SO4=MnSO4+2CO2↑+2H2O Mn2++H2O2+2OH-= MnO2↓+2H2O酸性条件下氧化性MnO2 >H2O2,碱性条件下氧化性MnO2<H2O2
解析
还原过程是先加入稀硫酸再加入草酸:MnO2+H2C2O4+H2SO4=MnSO4+2CO2↑+2H2O;在该过程中小组成员甲发现加入硫酸部分固体溶解剩余黑色固体,接着他没有加入草酸而是加入一定量的双氧水,发现固体也完全溶解了,常见的无污染的氧化剂为双氧水,目的是为除去杂质Fe2+:酸性条件下加入双氧水,将Fe2+氧化成Fe3+,2Fe2++2H2O2+2H+=2Fe3++2H2O,调节pH,使Fe3+沉淀完全,Fe3++3H2O⇌Fe(OH)3+3H+;成员乙在加硫酸后也没有加草酸,他又加入了一定量氨水,无明显变化,测得这时溶液的PH值为9,他接着又加入双氧水,发现黑色固体不减反增,导致固体增加的离子方程式:Mn2++H2O2+2OH-= MnO2↓+2H2O ;可见MnO2与H2O2酸性条件下氧化性和碱性条件下氧化性有差异。
考查方向
解题思路
本题考查了化学与技术、原电池原理、电极方程式的书写,综合性较强.
(1)①根据电池反应判断正负极和电解质;二氧化锰和铵根离子在正极发生反应;②根据碱性锌锰电池的特点分析;
(2)①根据电池的材料分析;②根据已知反应物和产物,再利用元素守恒③K2MnO4溶液中阴极产物的判断,根据溶液中阳离子得电子能力分析.
易错点
1、二氧化锰和铵根离子在正极发生反应。
2、电解MnSO4溶液回收锰的阳极产物的判断。
正确答案
重结晶;
解析
操作1和操作2使用到相同的装置,操作3的名称是重结晶。
考查方向
解题思路
本题考查了化学与技术、原电池原理、电极方程式的书写,综合性较强.
(1)①根据电池反应判断正负极和电解质;二氧化锰和铵根离子在正极发生反应;②根据碱性锌锰电池的特点分析;
(2)①根据电池的材料分析;②根据已知反应物和产物,再利用元素守恒③K2MnO4溶液中阴极产物的判断,根据溶液中阳离子得电子能力分析.
易错点
1、二氧化锰和铵根离子在正极发生反应。
2、电解MnSO4溶液回收锰的阳极产物的判断。
正确答案
MnSO4+ 2NH4HCO3 = MnCO3↓+ (NH4)2SO4+ CO2↑+H2O
解析
已知进行硫酸锰转化为碳酸锰的操作时,溶液(主要成分为MnSO4)会产生大量无色无味的气泡,反应为为MnSO4、NH4HCO3,产生的气体为二氧化碳,生成产物中还有硫酸铵、碳酸锰生成,反应的化学方程式为:MnSO4+2NH4HCO3=(NH4)2 SO4+MnCO3+H2O+CO2↑,故答案为:MnSO4+2NH4HCO3=(NH4)2 SO4+MnCO3+H2O+CO2↑.
考查方向
解题思路
本题考查了化学与技术、原电池原理、电极方程式的书写,综合性较强.
(1)①根据电池反应判断正负极和电解质;二氧化锰和铵根离子在正极发生反应;②根据碱性锌锰电池的特点分析;
(2)①根据电池的材料分析;②根据已知反应物和产物,再利用元素守恒③K2MnO4溶液中阴极产物的判断,根据溶液中阳离子得电子能力分析.
易错点
1、二氧化锰和铵根离子在正极发生反应。
2、电解MnSO4溶液回收锰的阳极产物的判断。
正确答案
MnO2+ NH4+ +eˉ = MnO(OH)+NH3 2H2O - 4eˉ = O2↑+4H+(或4OH- - 4eˉ = O2↑+ 2H2O)
解析
化学方程式Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnOOH,反应中Zn被氧化,为电池负极锌,氯化铵是电解质的主要成分,二氧化锰和铵根离子在正极发生反应,MnO2+NH4++e-=MnOOH+NH3;电解MnSO4溶液回收锰的阳极的电极反应式:2H2O - 4eˉ = O2↑+4H+(或4OH- - 4eˉ = O2↑+ 2H2O)。
考查方向
解题思路
本题考查了化学与技术、原电池原理、电极方程式的书写,综合性较强.
(1)①根据电池反应判断正负极和电解质;二氧化锰和铵根离子在正极发生反应;②根据碱性锌锰电池的特点分析;
(2)①根据电池的材料分析;②根据已知反应物和产物,再利用元素守恒③K2MnO4溶液中阴极产物的判断,根据溶液中阳离子得电子能力分析.
易错点
1、二氧化锰和铵根离子在正极发生反应。
2、电解MnSO4溶液回收锰的阳极产物的判断。
13. 下列说法正确的是( )
正确答案
解析
A、NaHA既能发生电离,也能发生水解,根据电荷守恒得c(OH-)+2 c(A2-)+c(HA-)=c(H+)+c(Na+),根据物料守恒得c(Na+)=c(A2-)+c(HA-)+c(H2A),所以得c(H+)+c(Na+)=c(OH-)+c(HA-)+2c(A2-),故A错误;
一定量的(NH4)2SO4与NH3•H2O混合所得的酸性溶液中铵根离子水解远远大于一水合氨的电离程度,溶液中c(NH4+)<2c(SO42-),故B错误;
物质的量浓度均为0.01mol/L的CH3COOH和CH3COONa的溶液等体积混合后溶液中存在微粒守恒:c(CH3COOH)+c(CH3COO-)=0.01 mol/L,故C错误 物质的量浓度相等的①NH4HSO4溶液中氢离子对铵根离子水解起到抑制作用、②NH4HCO3溶液中 碳酸氢根离子水解促进铵根离子水解、③NH4Cl溶液中氯离子对铵根离子水解无影响;
溶液中铵根离子浓度大小为:①>③>②,故D正确;
故选BC.
考查方向
解题思路
本题考查了电解质溶液中的水解和电离的综合分析应用,主要考查溶液中电荷守恒的应用,物料守恒的分析判断,溶液中离子浓度的大小比较,题目难度中等。
A、根据二元弱酸的酸式盐NaHA溶液中存在电荷守恒分析判断;
B、(NH4)2SO4与NH3•H2O混合所得的酸性溶液,说明铵根离子水解显示的酸性大于一水合氨电离显示的碱性;
C、依据溶液中物料守恒计算分析;
D、依据除铵根以外的另一种离子的性质对铵根离子水解的影响分析判断;
易错点
1、溶液中离子浓度的大小比较。
2、溶液中电荷守恒的应用,物料守恒的分析判断。
知识点
扫码查看完整答案与解析